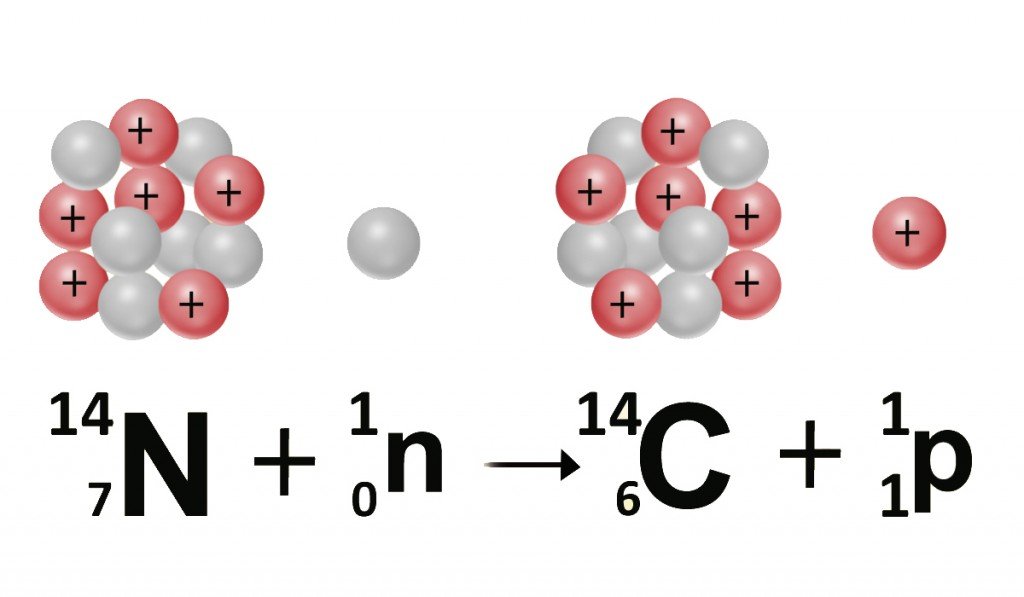Изотопы углерода и их значения в природе. Описание стабильных и радиоактивных изотопов углерода. Роль изотопного состава углерода в различных научных и практических областях.
Cодержание
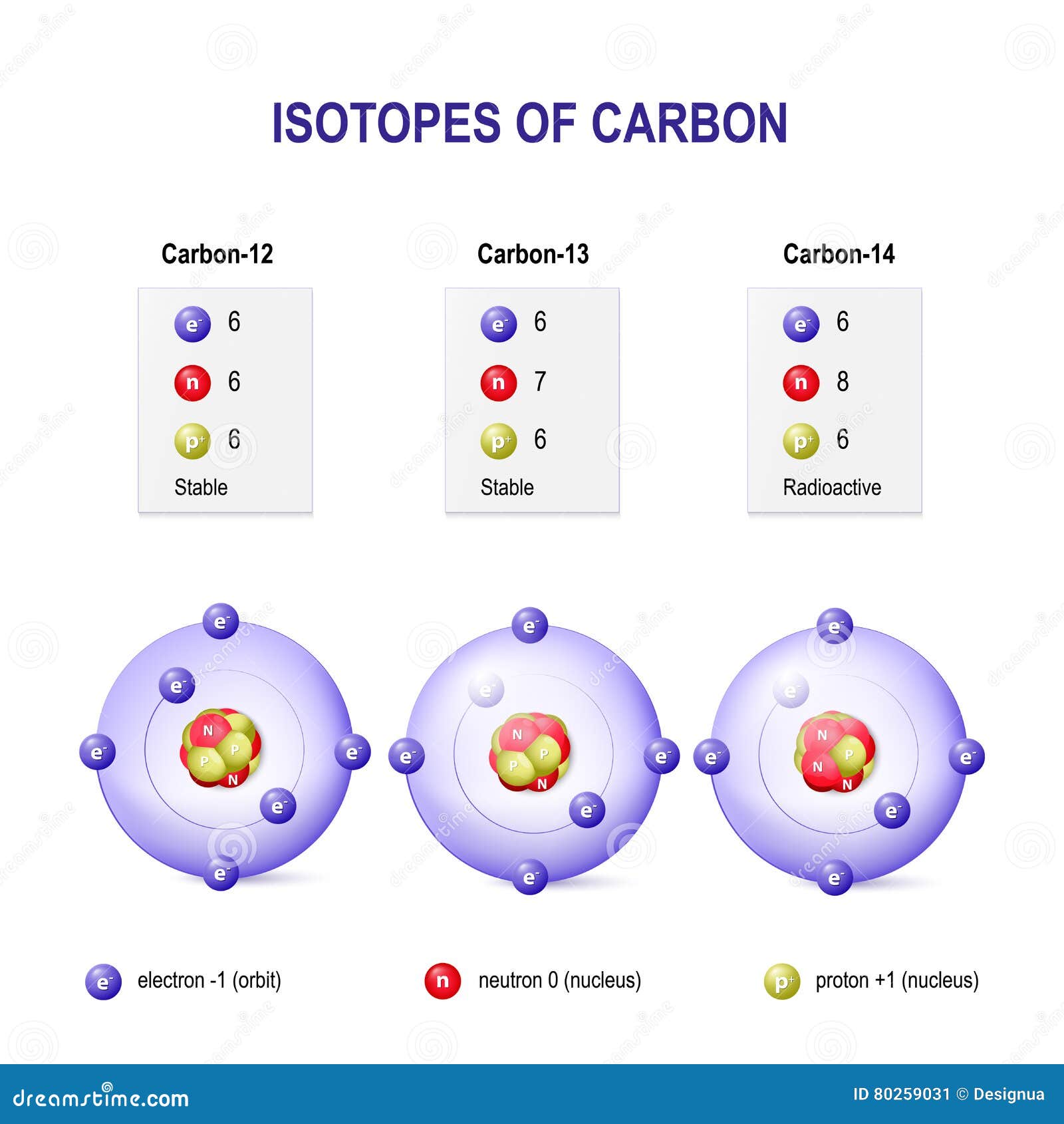
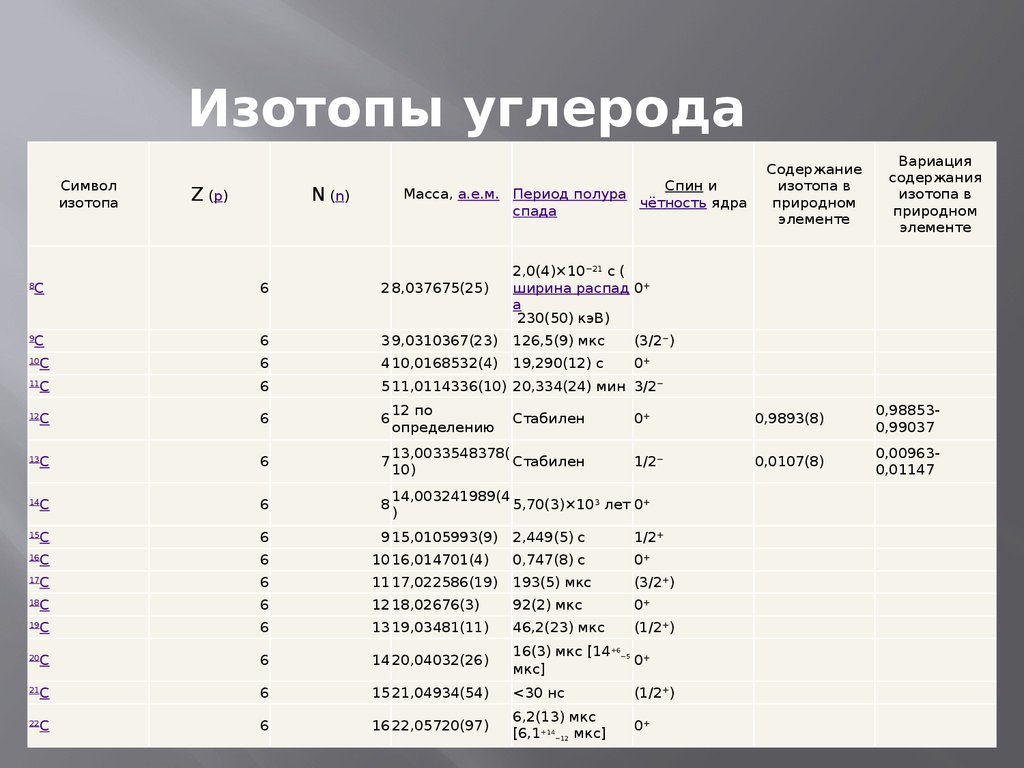
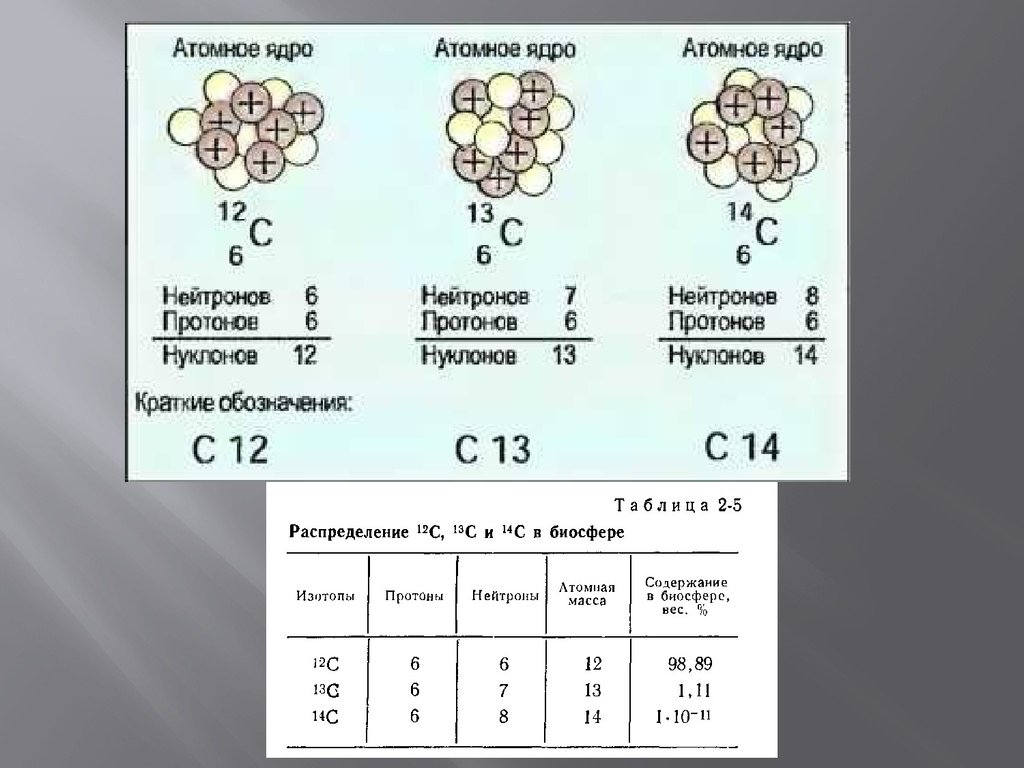
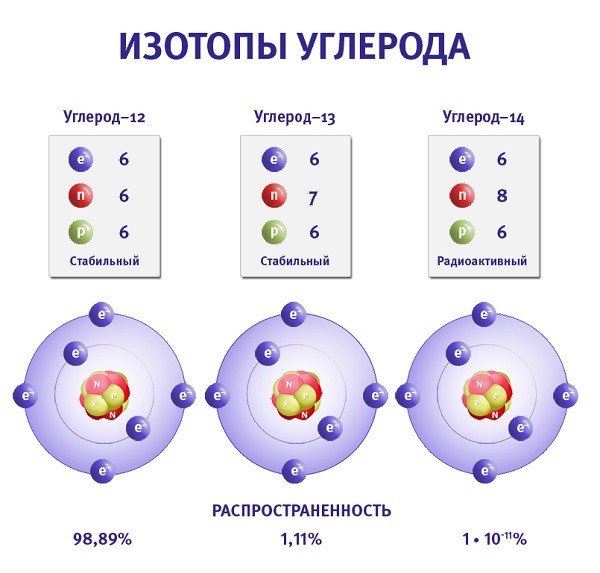
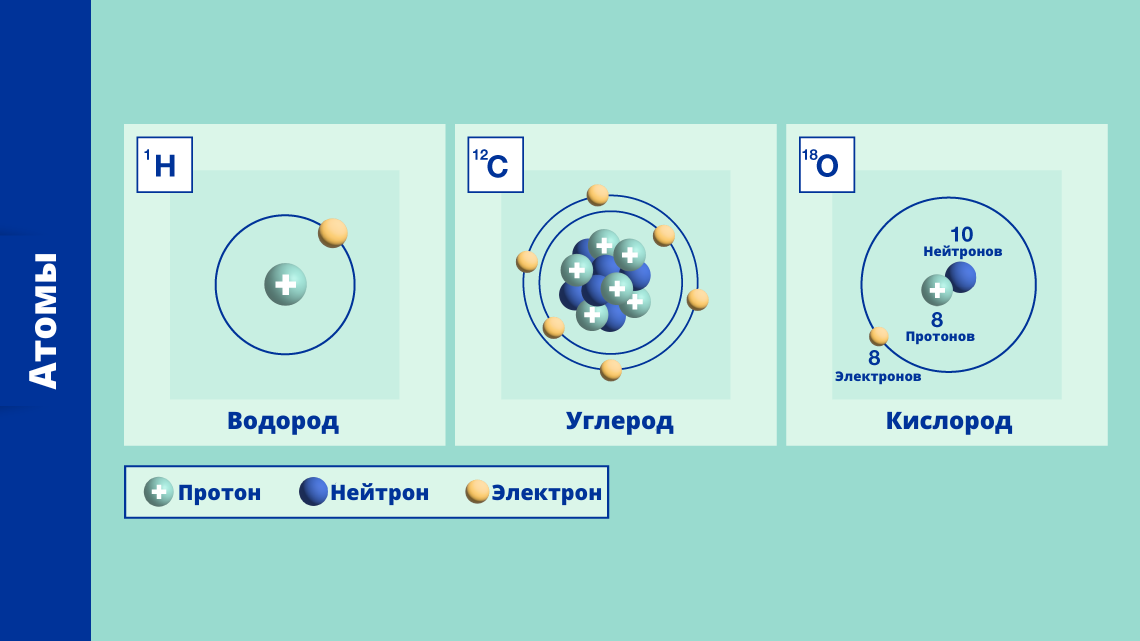
Изотопы углерода — разновидности атомов (и ядер) химического элемента углерода, имеющие разное содержание нейтронов в ядре. Углерод имеет два стабильных изотопа — 12C и 13C. Содержание этих изотопов в природном углероде равно соответственно 98,93 % и 1,07 %. Известны также 13 радиоактивных изотопов углерода (от 8C до 22C), из которых один — 14C — встречается в природе (его содержание в атмосферном углероде около 10^(-12)). Изомерные состояния неизвестны. Углерод — лёгкий элемент, и его изотопы значительно различаются по массе, а значит и по физическим свойствам, поэтому во многих природных процессах происходит их разделение (фракционирование). Самым долгоживущим радиоизотопом является 14C с периодом полураспада 5700 лет.

Таблица изотопов углерода
| Изотоп | Название |
|---|---|
| 12C | Углерод-12 |
| 13C | Углерод-13 |
| 14C | Углерод-14 |
Изотоп 14C
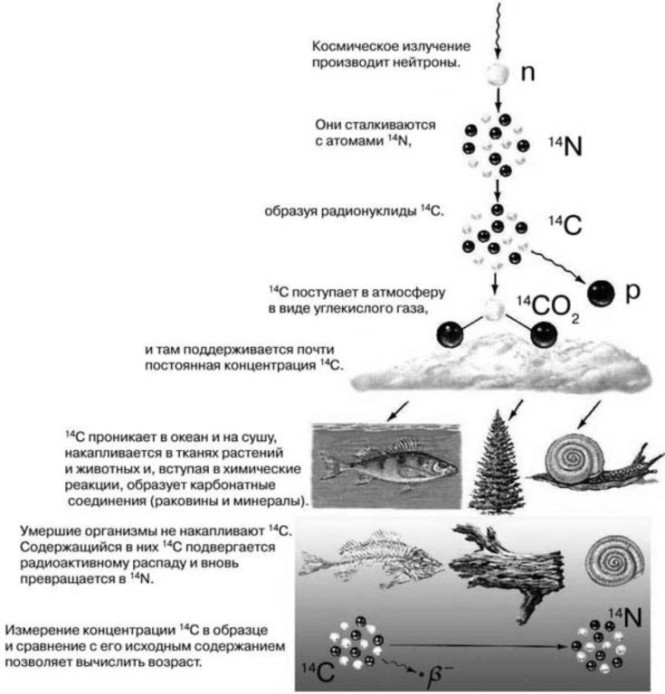
Помимо стабильных изотопов углерода в природе встречается радиоактивный изотоп 14C (радиоуглерод). Он образуется при облучении 14N нейтронами. В природе 14C образуется в атмосфере из атмосферного азота-14 под действием космического излучения. С небольшой скоростью углерод-14 образуется и в земной коре.
Равновесное содержание 14C в земной атмосфере и биосфере по отношению к стабильному углероду составляет около 10^(-12). С начала активного использования ископаемого топлива в атмосферу постоянно поступает углекислый газ, не содержащий радиоуглерода, что приводит к постепенному уменьшению отношения 14C/12C в атмосфере. Однако разбавление атмосферного углерода нерадиоактивным ископаемым углеродом привело лишь к незначительному уменьшению удельной активности 14C в атмосфере и океанах.

Радиоактивность изотопа углерода 14C
Изотопы — это совокупность атомов одного и того же элемента, имеющих одинаковый атомный номер, но разные массовые числа. Углерод имеет три изотопа: 14C, 13C и 12C. Наиболее распространенным является 12C — более 98%. Гораздо реже в природе встречается 13C. На Земле наименее распространен радиоактивный изотоп углерода 14C.
Углерод-14 образуется в верхних слоях тропосферы и стратосфере в результате поглощения атомами азота-14 тепловых нейтронов. Он обладает периодом полураспада, равным 5700 лет. Со временем содержание радиоактивных изотопов 14C в материале снижается. Радиоуглеродное датирование основано на измерении содержания углерода 14C в органических образцах и позволяет определить их возраст.
См. также
Радиоуглеродное датирование
Большая часть изотопа углерода 14C, который накапливается в атмосфере, окисляется до 14CO. Углекислый газ, 14CO2, попадает из атмосферы в биосферу и гидросферу. Радиоуглерод 14C входит в состав многих органических соединений и ассимилируется в растениях или растворяется в морской воде. Концентрация изотопа 14С в атмосфере в несколько раз выше, чем в глубинах океана, что делает его естественным изотопным индикатором. С помощью радиоуглеродного датирования можно отслеживать изменения, происходящие в природной среде.
Заключение
Изотопный состав углерода имеет большое значение для различных научных и практических областей, включая геологию, археологию и изучение изменений окружающей среды. Стабильные и радиоактивные изотопы углерода предоставляют уникальные возможности для определения возраста объектов и изучения процессов, происходящих в природе.

Что нам скажет Википедия?
Изото́пы углеро́да — разновидности атомов (и ядер) химического элемента углерода, имеющие разное содержание нейтронов в ядре. Углерод имеет два стабильных изотопа — 12C и 13C. Содержание этих изотопов в природном углероде равно соответственно 98,93 % и 1,07 %. Известны также 13 радиоактивных изотопов углерода (от 8C до 22C), из которых один — 14C — встречается в природе (его содержание в атмосферном углероде около 10−12). Изомерные состояния неизвестны. Углерод — лёгкий элемент, и его изотопы значительно различаются по массе, а значит и по физическим свойствам, поэтому во многих природных процессах происходит их разделение (фракционирование). Самым долгоживущим радиоизотопом является 14C с периодом полураспада 5700 лет.