В истории науки существовало несколько моделей атома, каждая из которых вносила свой вклад в понимание строения атома и его свойств. Узнайте, кто предложил планетарную модель атома и как она повлияла на развитие нашего понимания атомной структуры. Читайте статью на NOCFN.
Cодержание
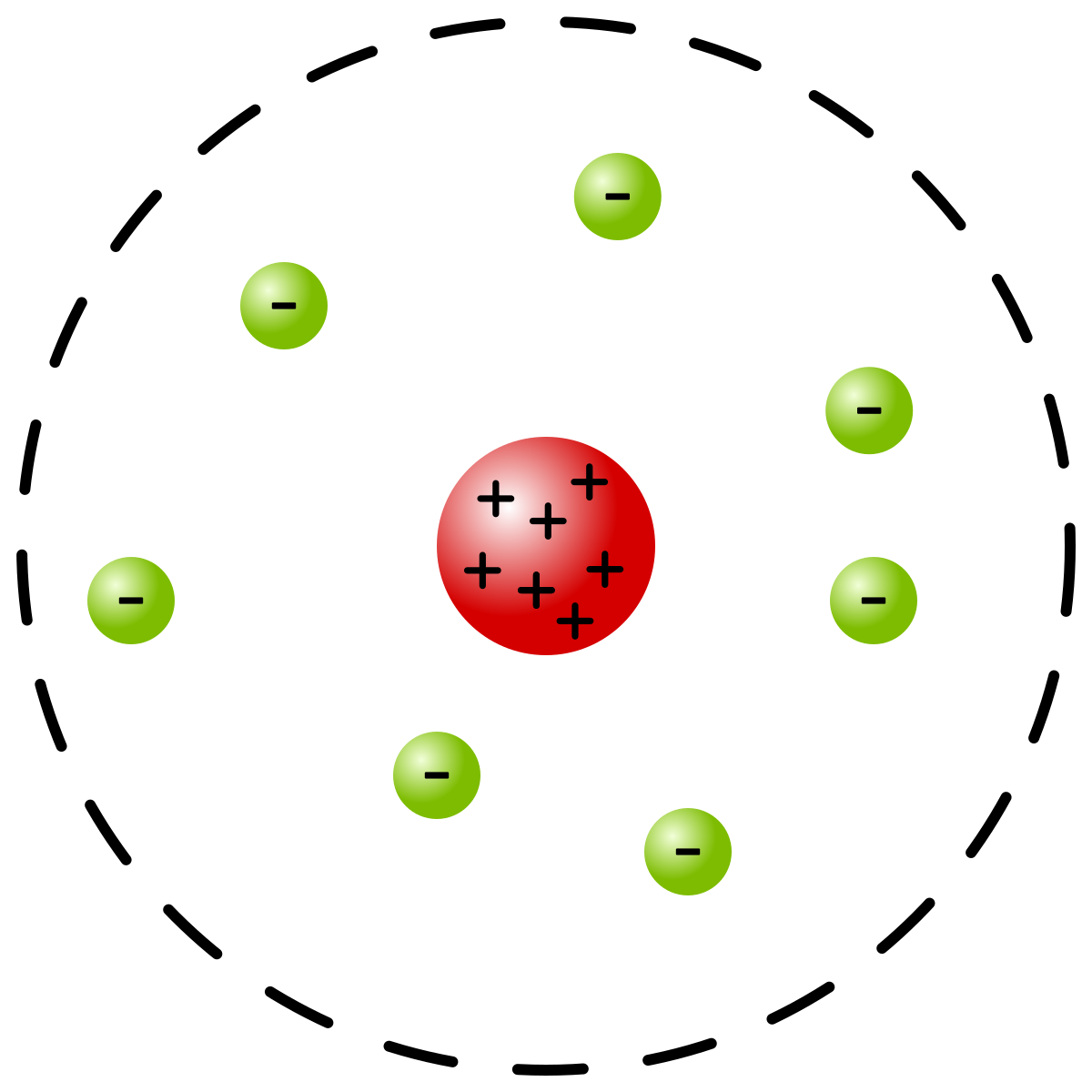
В истории науки существовало несколько моделей атома, каждая из которых вносила свой вклад в понимание строения атома и его свойств. Одной из таких моделей является планетарная модель атома, также известная как модель атома Резерфорда. Эта модель была предложена физиком Эрнестом Резерфордом в 1911 году на основании результатов экспериментов по рассеиванию альфа-частиц в золотой фольге.

Планетарная модель атома Резерфорда
Планетарная модель атома Резерфорда описывает атом как состоящий из крохотного положительно заряженного ядра, в котором сосредоточена почти вся масса атома, вокруг которого вращаются электроны подобно планетам, движущимся вокруг Солнца. Эта модель соответствует современным представлениям о строении атома, но с уточнениями, что движение электронов имеет квантовомеханическое описание и не может быть описано классической механикой.
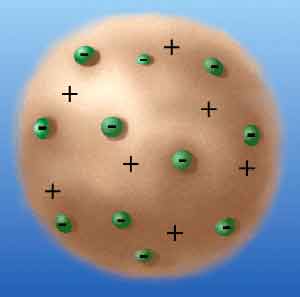
Планетарная модель атома Резерфорда пришла на смену предыдущей модели атома, известной как модель "пудинга с изюмом", предложенной Джозефом Джоном Томсоном в 1904 году. По этой модели, отрицательно заряженные электроны размещены на круговых орбитах внутри положительно заряженного атома, подобно изюминкам в пудинге. Однако эксперименты Резерфорда по рассеиванию альфа-частиц в золотой фольге показали, что это упрощенное представление не объясняет наблюдаемые результаты. Вместо этого, Резерфорд подтвердил предположение о планетарном строении атома, с ядром и вращающимися вокруг него электронами.

Предыстория и развитие модели атома
Перед тем, как Резерфорд предложил свою модель атома, существовали другие попытки объяснить строение и свойства атома. К примеру, в 1904 году японский физик Нагаока Хантаро разработал модель атома, известную как "атом типа Сатурна". Эта модель была построена на аналогии с расчетами устойчивости колец Сатурна и предполагала наличие массивного ядра в центре атома. Хотя модель Нагаоки оказалась неверной, некоторые ее аспекты стали отправной точкой для дальнейших исследований.
Сама модель атома Резерфорда была разработана на основе анализа экспериментов по рассеиванию альфа-частиц в золотой фольге, проведенных в 1909 году. Эти эксперименты показали, что большое количество альфа-частиц рассеивалось на большие углы, что указывало на наличие небольшого центрального рассеивающего центра с значительным электрическим зарядом и массой. Резерфорд провел расчеты и пришел к выводу, что этот центр должен быть по крайней мере в 3000 раз меньше размера атома и иметь противоположный электрический заряд по сравнению с электронами. Этот рассеивающий центр позднее был назван ядром.
Недостатком планетарной модели атома Резерфорда было то, что она не могла объяснить устойчивость атомов согласно законам классической электродинамики. По этим законам, электроны, движущиеся по орбитам вокруг ядра, должны излучать электромагнитные волны и потерять свою энергию, что должно было привести к их "падению" на ядро. Однако развитие квантовой механики позволило преодолеть это противоречие и объяснить устойчивость атомов.
См. также
Модель Бора и развитие квантовой механики
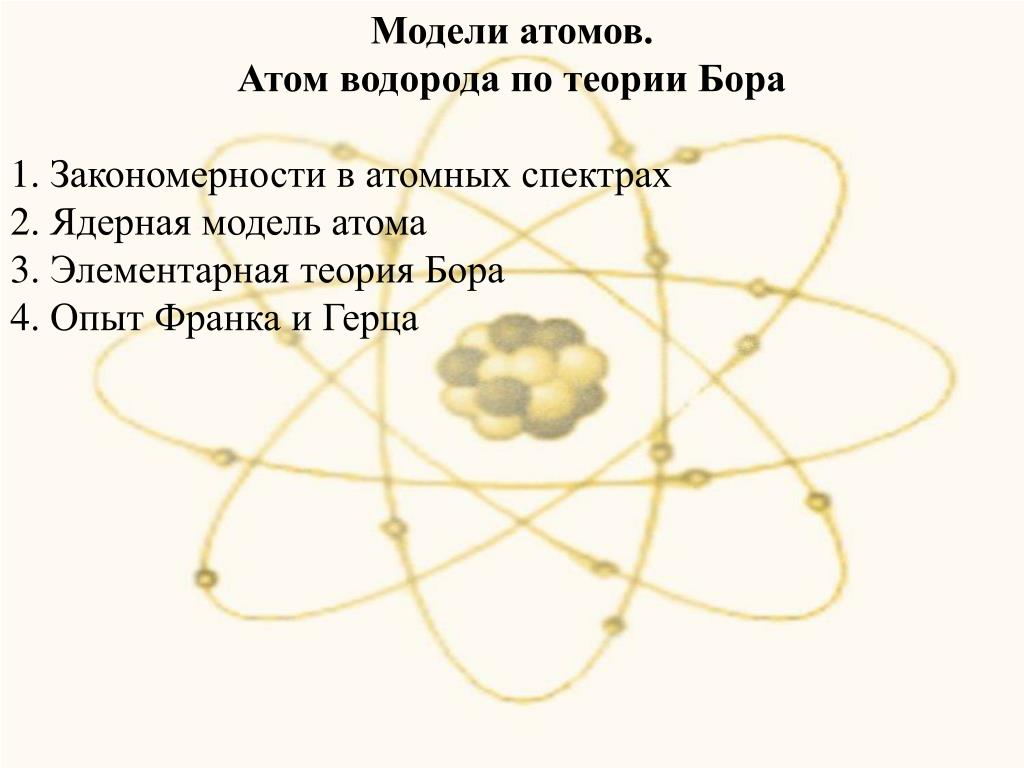
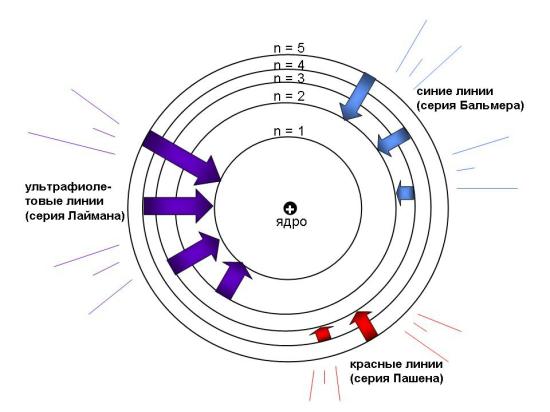
Последующее развитие планетарной модели атома Резерфорда привело к созданию модели атома Бора, которая впервые позволила удовлетворительно объяснить закономерности строения атома водорода. Модель Бора была разработана Нильсом Бором на основе представлений классической физики, дополненных квантовыми постулатами. Основные постулаты модели Бора утверждают, что электроны движутся по круговым орбитам вокруг ядра, частота их обращения квантуется, а энергия переходов между орбитами также квантуется.
Однако, модель Бора имела недостатки и не могла полностью объяснить все свойства атомов. Например, она не учитывала волновую природу электронов и не могла объяснить структуру атомных и ядерных спектров. Для решения этих проблем была разработана волновая механика, основанная на гипотезе де Бройля. В этой новой модели, электроны описываются волновыми функциями, а их движение и взаимодействие с ядром описываются квантовыми операторами.
Развитие квантовой механики позволило объяснить не только строение атомов, но и другие квантовые явления, такие как статистика Ферми-Дирака и Бозе-Эйнштейна. Статистики Ферми-Дирака и Бозе-Эйнштейна объясняют структуру атомов и атомных ядер, а также парные корреляции в атомной и ядерной среде.

Заключение
Таким образом, модель атома Резерфорда, предложенная в 1911 году, является важным этапом в развитии представлений о строении атома. Она установила понятие ядра и планетарного движения электронов вокруг него, что соответствует современным представлениям о строении атома. Однако, развитие квантовой механики показало, что движение электронов в атоме имеет квантовый характер и требует более точного математического описания.

Что нам скажет Википедия?
Предыстория
К 1904 году японский физик Нагаока Хантаро разработал раннюю, как оказалось впоследствии, ошибочную «планетарную модель» атома («атом типа Сатурна»). Модель была построена на аналогии с расчётами устойчивости колец Сатурна (кольца уравновешены из-за очень большой массы планеты). Модель Нагаоки была неверна, но два следствия из неё оказались пророческими:
Новую модель строения атома Резерфорд предложил в 1911 году на основе анализа экспериментов по рассеиванию альфа-частиц в золотой фольге, проведённых в 1909 году под его руководством.
При этом рассеянии большое, неожиданно статистически необъяснимое, количество альфа-частиц рассеивалось на большие углы, что свидетельствовало о том, что центр рассеяния имеет небольшие размеры, в нём сосредоточен значительный электрический заряд и масса атома.
Расчёты Резерфорда показали, что рассеивающий центр, заряженный положительно или отрицательно, должен быть по крайней мере в 3000 раз меньше размера атома, который в то время уже был известен и оценивался как примерно 10^-10 м. Поскольку в то время электроны уже были известны, а их масса и заряд определены, то рассеивающий центр, который позже назвали ядром, должен был иметь противоположный электронам заряд. Резерфорд не связал величину заряда с атомным номером. Этот вывод был сделан позже. А сам Резерфорд предположил, что заряд ядра пропорционален атомной массе. Связь электрического заряда ядра с атомным номером химического элемента установил Генри Мозли в экспериментах, выполненных в 1913 году.
Недостатком планетарной модели была невозможность объяснения ею устойчивости атомов. Так как электроны движутся вокруг ядра, испытывая при этом центростремительное ускорение как планеты вокруг Солнца, то они по законам классической электродинамики должны излучать электромагнитные волны, теряя при этом на излучение кинетическую энергию орбитального движения и в результате «упасть» на ядро. Расчёты, выполненные с помощью методов классической электродинамики показывают, что электроны должны «упасть» на ядро за время порядка 10^-11 с.
Это противоречие было снято последующим развитием планетарной модели в модели атома Бора, постулирующая другие, отличные от классических законы орбитального движения электронов на основе волн де Бройля. Полностью противоречащие эксперименту выводы классической электродинамики смогло объяснить развитие квантовой механики.