Слабая кислота представляет собой кислоту, которая частично диссоциирована на ее ионы в водном растворе или воде. Узнайте, что такое слабая кислота, как она отличается от сильной и какие примеры слабых кислот существуют. Подробнее на NOCFN.
Cодержание
Слабая кислота представляет собой кислоту, которая частично диссоциирована на ее ионы в водном растворе или воде. При той же концентрации слабые кислоты имеют более высокое значение рН, чем сильные.
Слабые кислоты гораздо более распространены, чем сильные кислоты. Например, они встречаются в повседневной жизни в уксусной кислоте (уксус) и лимонной кислоте (лимонный сок). Уксусная кислота является типичной слабой кислотой. Она частично ионизирована в своем растворе CH₃COOH.
Слабые кислоты и основания
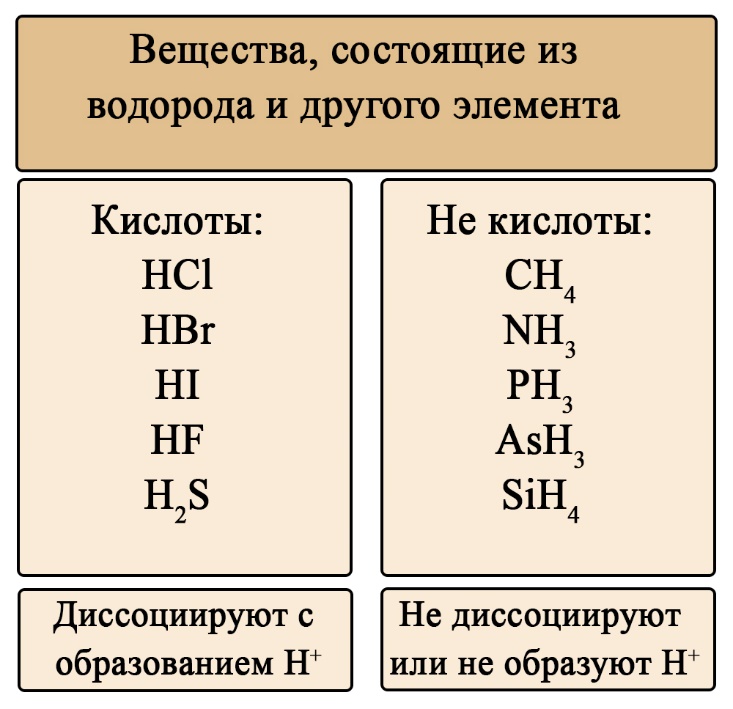
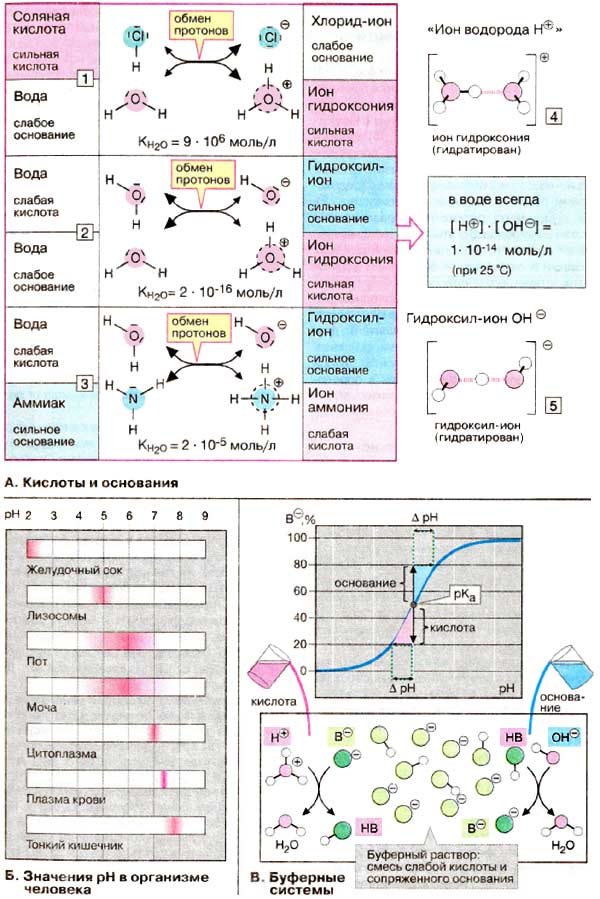
Слабыми кислотами называются кислоты, которые диссоциируют не полностью (в отличие от сильных кислот), т.е. частично. Ниже представлена реакция взаимодействия уксусной кислоты с водой:

Вступая во взаимодействие с водой, уксусная кислота диссоциирует только на 5%, в то же время, 95% кислоты остается в молекулярном виде, поэтому концентрация ионов гидроксония в растворе слабой кислоты значительно меньше, чем в растворе сильной кислоты.
Поскольку слабые кислоты диссоциируют частично, определение концентрации ионов гидроксония в их растворах достаточно сложно. Для этого необходимо использовать выражение для константы равновесия слабой кислоты, которая характеризует диссоциацию слабого электролита и называется константой диссоциации K.
Если в справочной таблице рядом с названием кислоты приведена ее константа диссоциации, это указывает на то, что кислота является слабой. В противном случае, кислота считается сильной.
В общем случае диссоциация слабой кислоты выражается в виде (HA - любая слабая кислота; [HA] - молярная концентрация слабой кислоты при установившемся равновесии):
HA ⇌ H⁺ + A⁻
Например, для уксусной кислоты константа диссоциации равна 1,8·10-5. Формула для константы диссоциации уксусной кислоты выглядит следующим образом:
K = [H⁺][A⁻] / [HA]
Данная формула позволяет вычислить концентрацию ионов гидроксония.
Для примера, предположим, что первоначальная концентрация уксусной кислоты составляет 1 моль/л. Известно, что только незначительная часть уксусной кислоты продиссоциировала, образовав при этом некоторое количество ионов гидроксония и ацетата. Поскольку уравнение реакции является сбалансированным, на каждый ион гидроксония образуется один ион ацетата, и их концентрации будут одинаковыми. Таким образом, концентрация ионов гидроксония будет равна концентрации ионов ацетата.
Слабые кислоты, такие как уксусная кислота, имеют широкий спектр применений. Они используются в пищевой промышленности, в фармацевтической продукции, в производстве удобрений и многих других отраслях.
В заключение, слабая кислота - это кислота, которая диссоциирует частично, образуя ионы в водном растворе. Уксусная кислота является примером слабой кислоты и имеет широкое применение в различных отраслях.