Кислоты являются важными соединениями в химии. Они играют роль во многих химических реакциях и имеют различные свойства. Кислоты могут быть слабыми или сильными в зависимости от их способности отдавать или принимать протоны. В данной статье мы рассмотрим, как определить, что кислота является слабой или сильной.
Cодержание
Кислоты являются важными соединениями в химии. Они играют роль во многих химических реакциях и имеют различные свойства. Кислоты могут быть слабыми или сильными в зависимости от их способности отдавать или принимать протоны. В данной статье мы рассмотрим, как определить, что кислота является слабой или сильной.
Определение кислотности
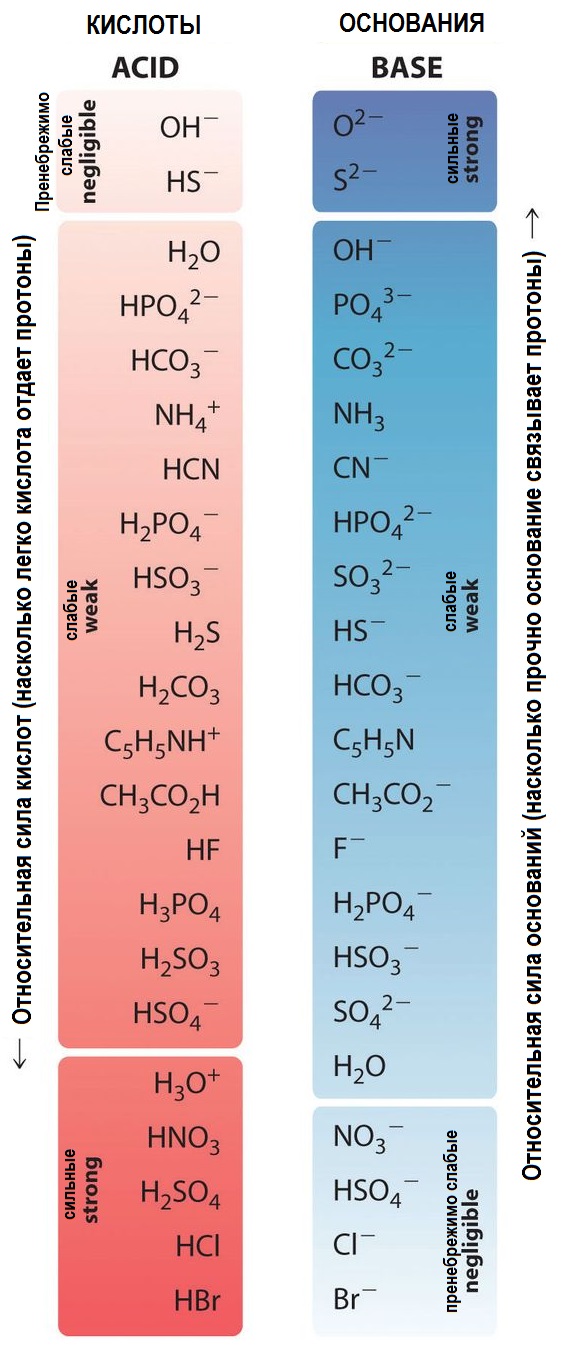
Кислотность или кислотные свойства вещества связаны с его способностью отдавать протоны. Чем больше протонов может отдать вещество, тем сильнее является кислота. Слабые кислоты отдают протоны в меньшей степени, в то время как сильные кислоты отдают протоны полностью или почти полностью.
Константа кислотности
Для количественной оценки кислотности используется константа кислотности, обозначаемая как Ka. Константа кислотности показывает, насколько кислота диссоциирует в растворе. Чем больше значение Ka, тем сильнее кислота.
Константа кислотности определяется как отношение концентрации протонов и концентрации неионизованных кислотных молекул в растворе. Исходя из этого, можно сделать вывод, что чем больше концентрация протонов и чем меньше концентрация неионизованных молекул, тем сильнее кислота.
Кислоты первичные и вторичные
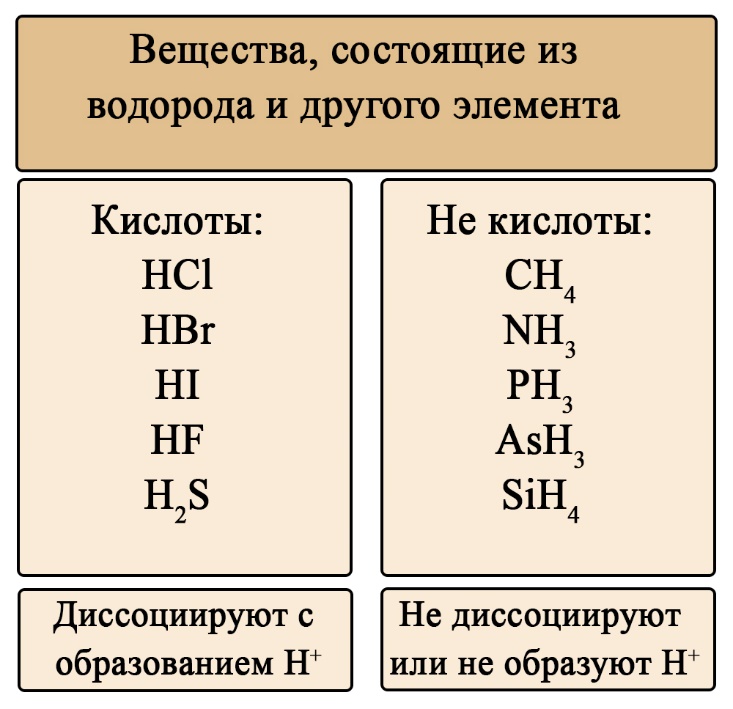
Кислоты могут быть классифицированы как первичные и вторичные. Первичные кислоты имеют только одну кислотную группу, способную отдавать протоны. Это, как правило, органические кислоты, такие как уксусная кислота (CH3COOH) или соляная кислота (HCl).
Вторичные кислоты имеют две или более кислотных группы и могут отдавать несколько протонов. Примером вторичной кислоты является серная кислота (H2SO4), которая имеет две кислотные группы и может отдать два протона.
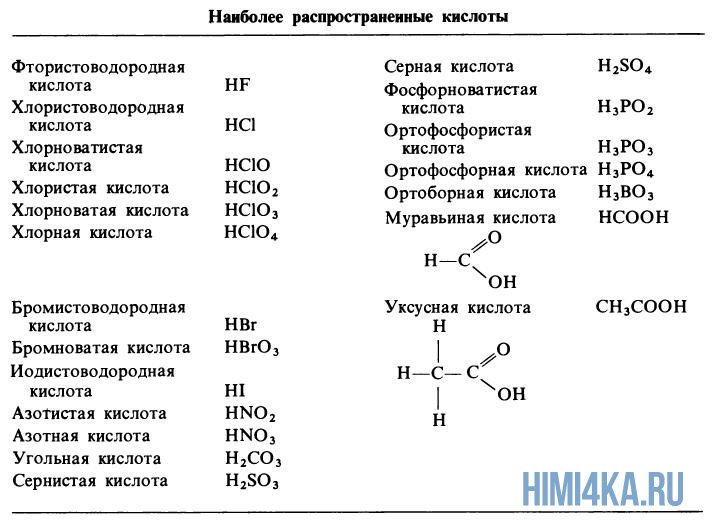
Таблица сильных и слабых кислот
| Сильные кислоты | Слабые кислоты |
|---|---|
| Соляная кислота (HCl) | Уксусная кислота (CH3COOH) |
| Серная кислота (H2SO4) | Угольная кислота (H2CO3) |
| Соляная кислота (HNO3) | Формициновая кислота (HCOOH) |
В таблице представлены примеры сильных и слабых кислот. Сильные кислоты полностью диссоциируют в растворе, отдавая все свои протоны. Слабые кислоты диссоциируют только частично, оставляя некоторое количество неионизованных молекул в растворе.
Определение силы кислоты
Силу кислоты можно определить по реакции с щелочью. Если кислота реагирует с щелочью и образует соль и воду, она считается сильной кислотой. Если же реакция с щелочью не происходит или происходит очень медленно, кислота считается слабой.
Также можно использовать значение константы кислотности (Ka) для определения силы кислоты. Чем больше значение Ka, тем сильнее кислота. Если значение Ka очень мало, то кислота будет считаться слабой.
Заключение
Определение слабой и сильной кислоты основано на их способности отдавать протоны. Константа кислотности и реакция с щелочью используются для количественной и качественной оценки силы кислоты. Зная эти методы, можно определить, какая кислота является слабой или сильной.