Изотопы водорода играют важную роль в химических исследованиях и используются в различных областях, таких как спектроскопия ядерного магнитного резонанса и изучение реакций с участием атомов водорода. Понимание различий между изотопами водорода помогает расширить наши знания о свойствах этого элемента и его влиянии на окружающую среду. - NOCFN
Cодержание
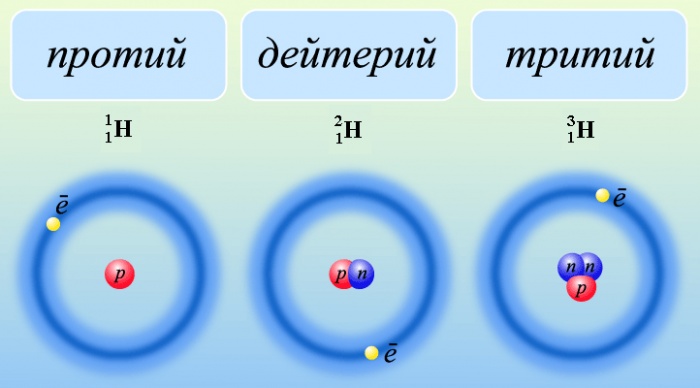
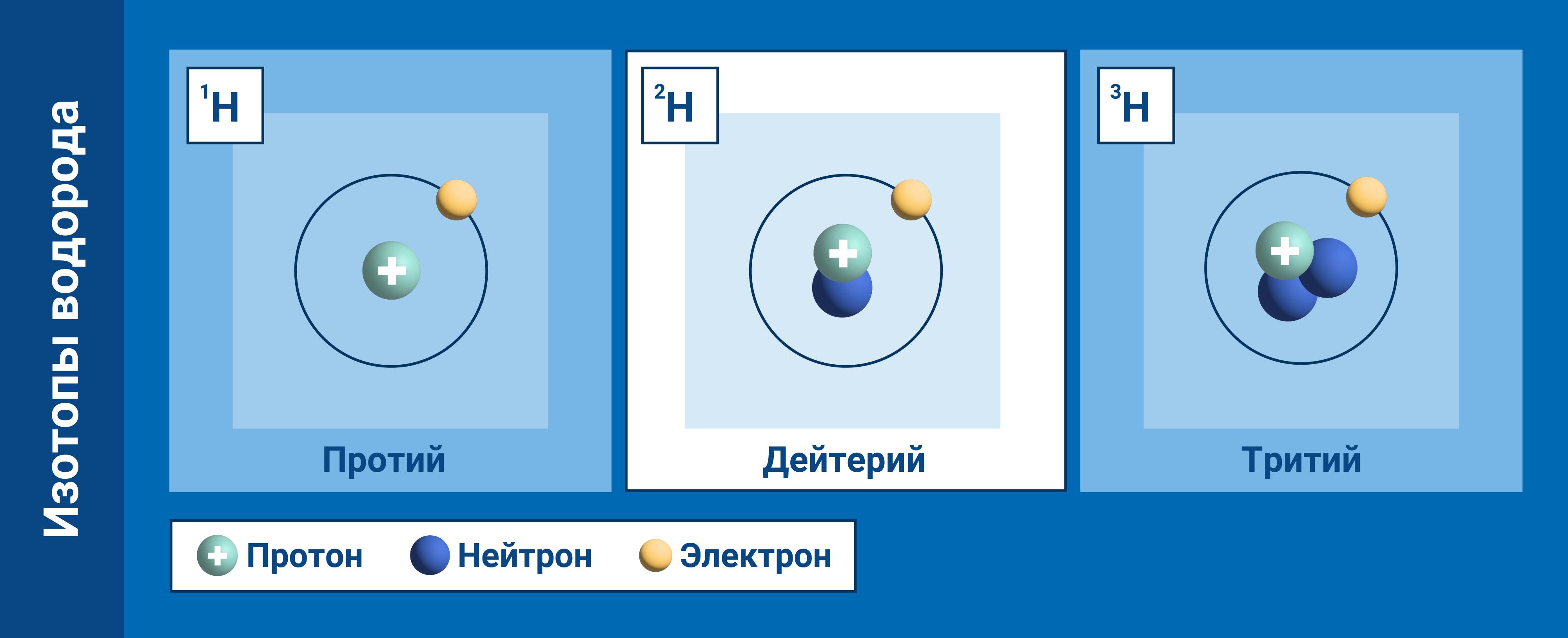
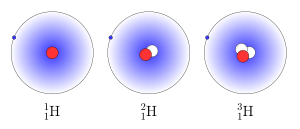
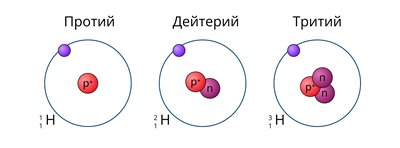
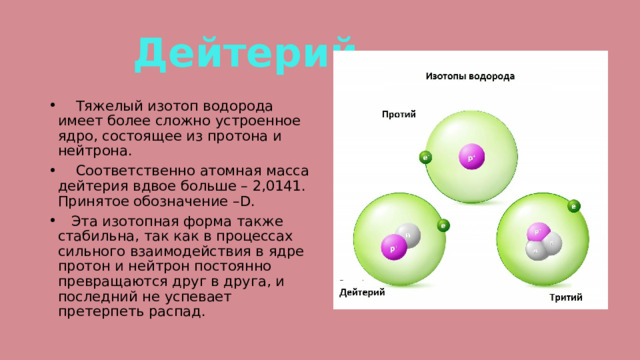
Изото́пы водоро́да — разновидности атомов (и ядер) химического элемента водорода, имеющие разное количество нейтронов в ядре. На данный момент известны 7 обычных изотопов водорода, а также один экзотический атом водород-4.1 (мюоний, 4He-μ)[1].
Наиболее распространённые изотопы водорода
Наиболее распространённым изотопом водорода в природе является протий 1H (99,984 %). Другой изотоп водорода, дейтерий 2H (или D), несмотря на малую распространённость в природе (0,0156 %) играет чрезвычайно важную роль в химических исследованиях. Например, дейтерийсодержащие соединения используются в спектроскопии ядерного магнитного резонанса (ЯМР). Особенно важны дейтерированные препараты (соединения с так называемыми дейтериевыми метками) при изучении реакций с участием атомов водорода.
Третий из наиболее распространённых изотопов водорода — тритий, обозначаемый T или 3H, является радиоактивным с периодом полураспада 12,3 года. Все остальные радиоизотопы имеют короткие периоды полураспада, много меньше миллисекунды.

Таблица изотопов водорода
| Изотоп | Символ | Масса (унифицированная атомная масса) | Процент содержания в природе |
|---|---|---|---|
| Протий | 1H | 1.007825 | 99.984 % |
| Дейтерий | 2H | 2.014102 | 0.0156 % |
| Тритий | T, 3H | 3.016049 | Радиоактивный, период полураспада 12,3 года |
| Изотоп водород-4.1 (мюоний) | 4He-μ | 4.1000 | Экзотический атом |
См. также
Особенности изотопов водорода
Каждый химический элемент отличается от других количеством содержащихся в нем протонов, нейтронов и электронов. Атомы каждого элемента имеют определенное равное количество протонов и электронов, но, что очень важно — не нейтронов, число которых может меняться.
Атомы с одинаковым количеством протонов, но разным количеством нейтронов называются изотопами. Они обладают практически одинаковыми химическими свойствами, но отличаются по массе и, следовательно, по физическим свойствам. Существуют стабильные изотопы, которые не излучают радиацию, и нестабильные изотопы, которые излучают радиацию. Последние называются радиоизотопами.
Водород, будучи простым веществом, практически не встречается в природе. В небольших количествах он встречается в вулканических газах. Простейшая молекула водорода состоит из двух водородных атомов, то есть из двух ядер атомов водорода и двух электронов. Взаимодействие между ядрами и электронами осуществляется по принципам ковалентной неполярной химической связи[4].

История открытия элемента водород
Английский химик Генри Кавендиш изучал воздухоподобное вещество, выделяющееся при растворении металлов в кислотах. В 1766 году он опубликовал работу, которая была посвящена «горючему воздуху». В данной работе Кавендиш первым описал свойства водорода, а также разработал новые способы его получения, путём растворения цинка или олова в соляной кислоте.
Изучив свойства водорода, Кавендиш сделал предположение, что водород есть не что иное, как флогистон. Его гипотеза заключалась в том, что металлы при растворении в кислотах теряют флогистон. Учёный рассчитал удельный вес водорода путем взвешивания колбы с кислотой и цинка до начала взаимодействия, а затем их массу уже после взаимодействия.
Разница в массе, по мнению Кавендиша, объяснялась массой выделившегося в ходе реакции водорода. После производства расчётов Кавендиш установил, что «горючий газ» легче воздуха в 14 раз. Если резиновый шарик наполнить водородом, он взлетает вверх. Данное свойство водорода использовалось для заполнения газом воздушных шаров и дирижаблей.
Генри Кавендиш получал водород различными способами, в стремлении доказать, что это вещество обладает одними и теми же свойствами независимо от способа его получения.
Латинское название водорода Hydrogene было предложено в 1784 году Антуаном Лораном Лавуазье. Русское название «водород» было предложено Михаилом Фёдоровичем Соловьевым в 1824 году[5].

Заключение
Изотопы водорода играют важную роль в химических исследованиях и используются в различных областях, таких как спектроскопия ядерного магнитного резонанса и изучение реакций с участием атомов водорода. Понимание различий между изотопами водорода помогает расширить наши знания о свойствах этого элемента и его влиянии на окружающую среду. История открытия водорода свидетельствует о постоянном развитии науки и стремлении ученых понять природу элементов и их свойства.