Узнайте, что такое слабая кислота, и как она диссоциирует частично. Изучите процесс диссоциации слабой кислоты и ее константу диссоциации. Познакомьтесь с примерами слабых кислот в повседневной жизни и общими свойствами кислот.
Cодержание
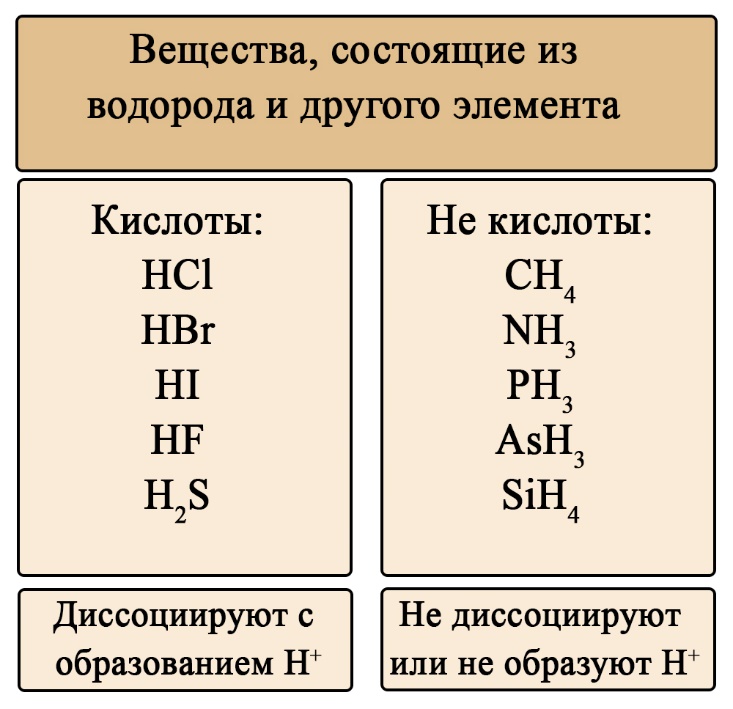
Слабыми кислотами называются кислоты, которые диссоциируют не полностью (в отличие от сильных кислот), т.е. частично. Диссоциация кислоты представляет собой процесс расщепления молекулы кислоты на ионы в растворе. Ниже представлена реакция взаимодействия уксусной кислоты с водой:

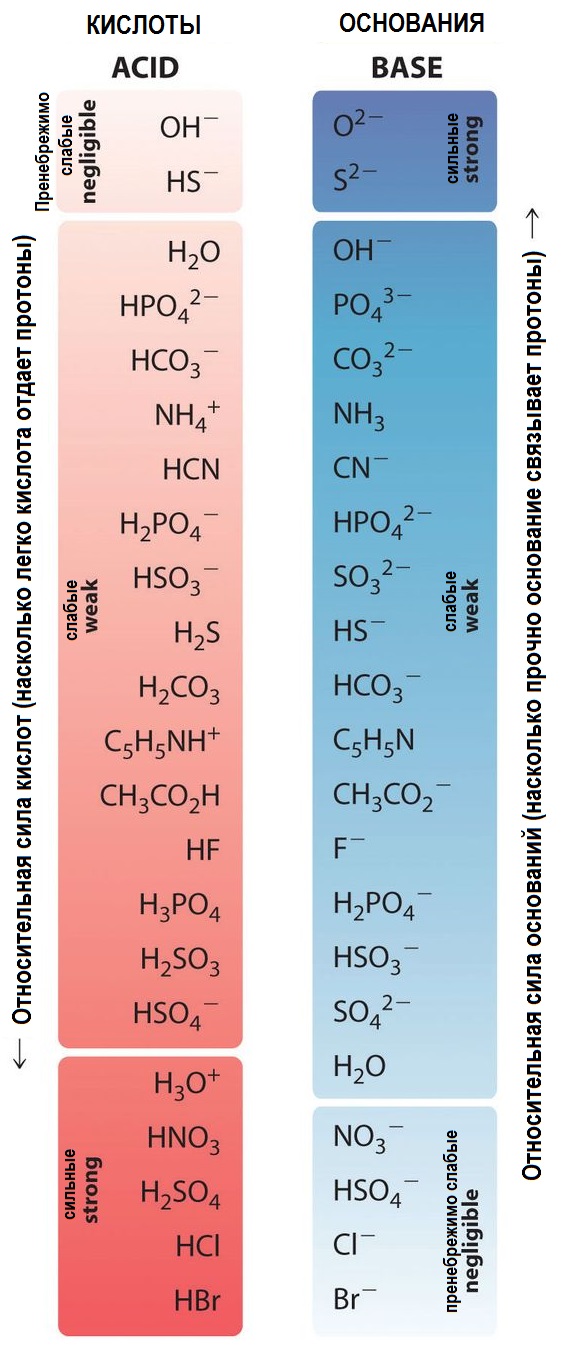
Двусторонняя стрелка, разделяющая левую и правую части реакции, говорит о том, что она протекает одновременно в двух направлениях (система находится в равновесии), прямая и обратная реакции протекают с одинаковой скоростью. Вступая во взаимодействие с водой, уксусная кислота диссоциирует только на 5%, в то же время, 95% кислоты остается в молекулярном виде, по этой причине концентрация ионов гидроксония во много раз меньше, чем в растворе сильной кислоты.

Определение концентрации ионов гидроксония
Поскольку слабые кислоты диссоциируют частично, то определить концентрацию ионов гидроксония в их растворах достаточно сложно. Для этого необходимо использовать выражение для константы равновесия слабой кислоты, которая характеризует диссоциацию слабого электролита, и называется константой диссоциации K.
Уравнение для константы диссоциации уксусной кислоты записывается в следующем виде:

Данная формула позволяет вычислить концентрацию ионов гидроксония. Например, для уксусной кислоты константа диссоциации равна 1,8·10-5. При известной первоначальной концентрации уксусной кислоты, можно определить концентрацию ионов гидроксония и ацетата в растворе.

Слабые кислоты в повседневной жизни
Слабые кислоты гораздо более распространены, чем сильные кислоты. Они встречаются в повседневной жизни, например в уксусной кислоте (уксус) и лимонной кислоте (лимонный сок). Уксусная кислота является типичной слабой кислотой. Она частично ионизирована в своем растворе CH₃COOH.
См. также
Общие свойства кислот
Кислоты наряду с основаниями, солями и металлами представляют один из самых распространенных видов химических соединений. Физические и химические свойства кислот могут различаться в зависимости от их состава и структуры.
Физические свойства
Кислоты обладают кислым вкусом и могут иметь разные цвета и запахи. Они могут находиться в твердом, жидком или газообразном состоянии.
Химические свойства
Кислоты обладают рядом общих химических свойств, включая способность отдавать протон или присоединять анионы. Концентрация кислоты определяет ее силу, которая выражается через константу кислотности или кислотную постоянную.

Теории кислот и оснований
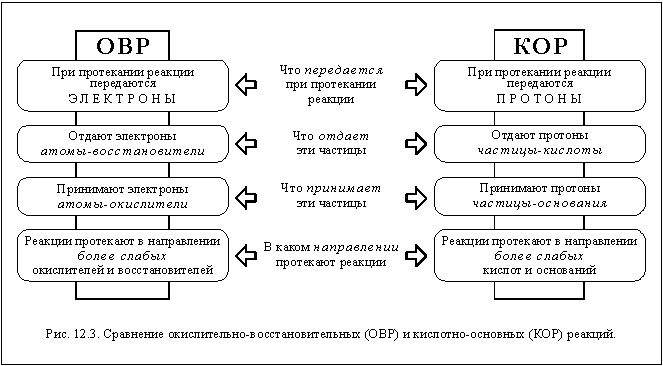
Существует несколько теорий, объясняющих природу кислот и оснований. Одна из них - теория Брёнстеда, которая определяет кислоту как частицу, способную отдавать протон, и основание как частицу, способную принять протон. Другая теория - теория Льюиса, которая рассматривает кислоту как вещество, способное принять пару электронов.
Таким образом, слабая кислота представляет собой кислоту, которая частично диссоциирована на ее ионы в водном растворе или воде. При той же концентрации слабые кислоты имеют более высокое значение рН, чем сильные.
Важно отметить, что изучение кислот и их свойств является фундаментальным для понимания различных химических процессов и применения их в различных областях науки и технологии.

Что нам скажет Википедия?
Усанович сформулировал общую теорию кислот и оснований, согласно которой кислотой является частица, которая может отдавать катионы, в том числе протон, или присоединять анионы, в том числе электрон. Таким образом, понятие кислоты, по Усановичу, включает как кислоты Брёнстеда, так и кислоты Льюиса, а также окислители.
В 1939 году М. И. Усанович сформулировал общую теорию кислот и оснований, согласно которой кислотой является частица, которая может отдавать катионы, в том числе протон, или присоединять анионы, в том числе электрон. Таким образом, понятие кислоты, по Усановичу, включает как кислоты Брёнстеда, так и кислоты Льюиса, а также окислители.
Традиционно для простейших карбоновых кислот наиболее распространены тривиальные названия, некоторые из которых образовались ещё в XVII веке (уксусная кислота, масляная кислота, адипиновая кислота, фталевая кислота). Высшие карбоновые кислоты с чётным числом атомов углерода также имеют тривиальные названия, которые, однако, так сходны, что их употребление может вызывать путаницу (каприловая кислота, каприновая кислота).
Систематические названия карбоновых кислот образуются путём добавления окончания -овая кислота к названию соответствующего кислоте алкана (гексановая кислота, пентакозановая кислота). В случае дикарбоновых кислот используется окончание -диовая кислота (декандиовая кислота). Иногда название более удобно образовывать при помощи окончания -карбоновая кислота, которое означает замену одного атома водорода в соединении на карбоксильную группу. Такой подход применяется в тех случаях, когда карбоксильная группа присоединена к циклической системе (циклопропанкарбоновая кислота).
Если в карбоновой кислоте содержится пероксидный мостик, то к названию таких кислот добавляются приставки перокси-, пер- или над- (надуксусная кислота, пероксибензойная кислота).
Для обозначения серосодержащих органических кислот используют окончания -сульфоновая кислота (RSO3H), -сульфиновая кислота (RSO2H), -сульфеновая кислота (RSOH), аналогичным образом добавляя их к названию родоначального алкана RH.
Теория кислот и оснований Брёнстеда, рассматривающая кислоту, как частицу, способную отдавать протон, даёт возможность количественно оценить эту способность кислоты — её силу. Сила кислот описывается при помощи константы равновесия реакции диссоциации кислоты в водном растворе, которая называется константой кислотности или кислотной постоянной.