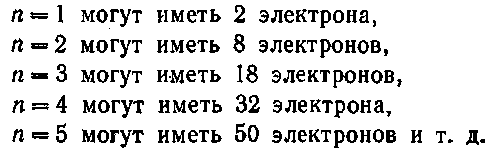Атомы состоят из ядра и вращающихся вокруг него электронов. Узнайте, как определить количество электронов в атоме, и как они распределяются по энергетическим уровням и оболочкам. Читайте больше на NOCFN.
Cодержание
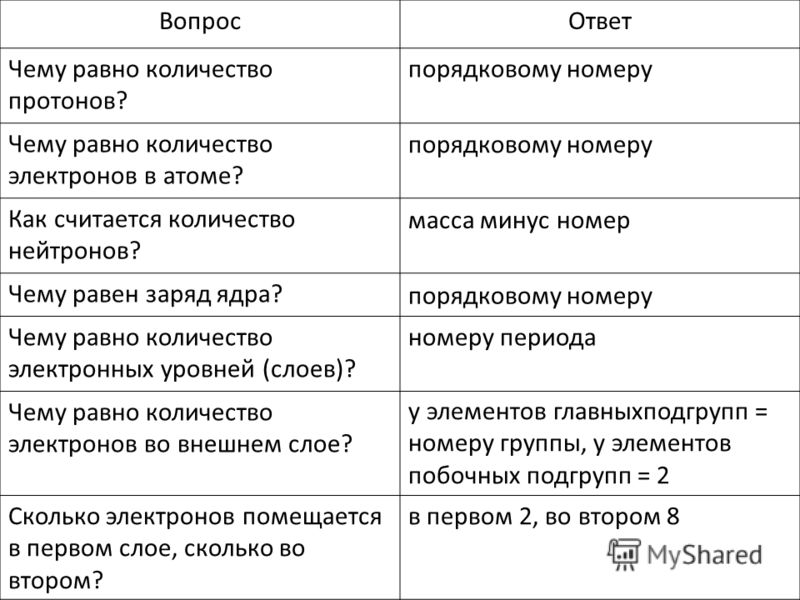
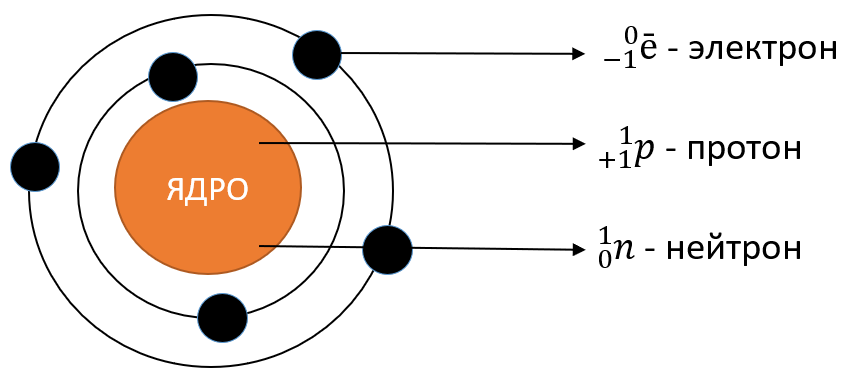
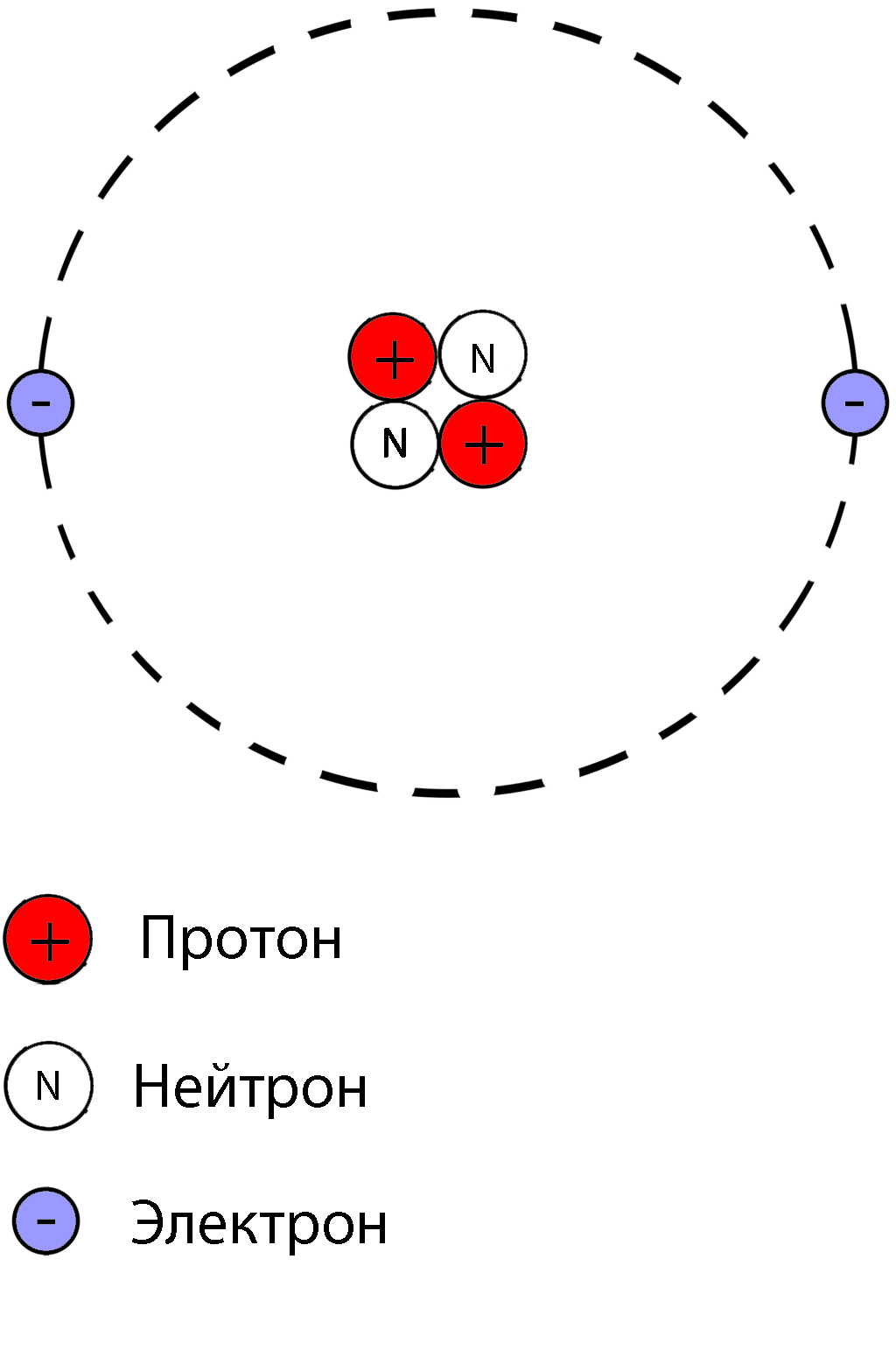
Атомы состоят из ядра и вращающихся вокруг него электронов. Общее число электронов в атоме равно порядковому номеру химического элемента в Периодической таблице. Каждый электрон находится на своей орбитали. Чем больше энергия электрона, тем больше по размеру его орбиталь, и тем дальше он находится от ядра.
Строение атома
Строение атома было подробно исследовано различными учеными на протяжении истории. Изначально, атом рассматривался как неделимая частица. Однако в 1911 году Э. Резерфорд показал, что атом состоит из положительно заряженного ядра и вращающихся вокруг него электронов. Эта модель атома получила название "Планетарная модель атома".
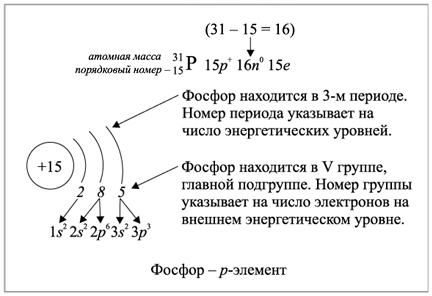
Число электронов в атоме равно числу протонов, так как атом в целом является электронейтральным. Заряд ядра также равен порядковому номеру химического элемента. Масса атома сосредоточена в ядре, которое состоит из протонов и нейтронов. Число нейтронов можно рассчитать как разницу между массовым числом и зарядом ядра.
Энергетические уровни и электронные оболочки
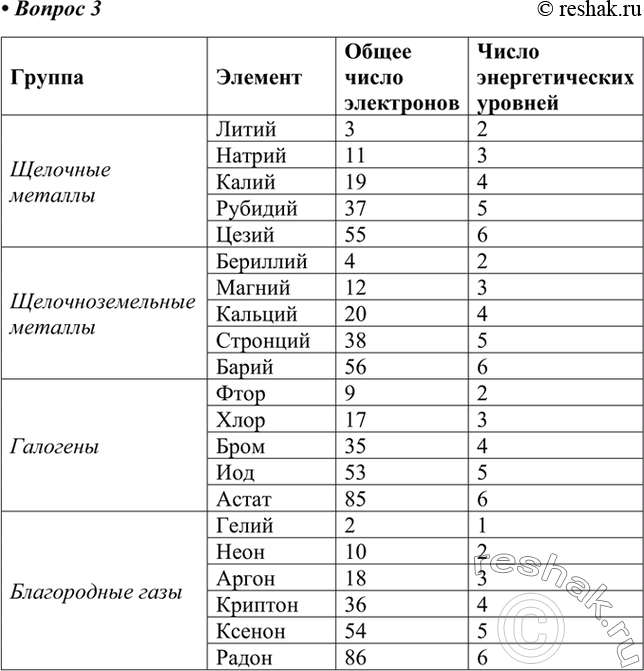
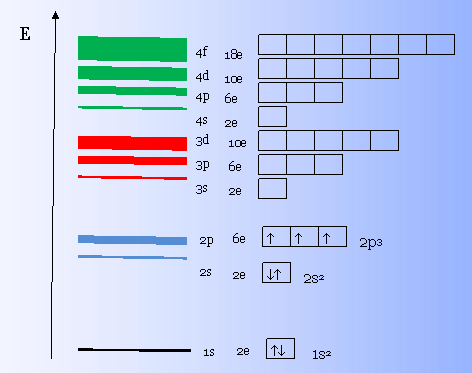
Электроны располагаются на энергетических уровнях, также называемых электронными оболочками. Число энергетических уровней определяется номером периода химического элемента. На каждом энергетическом уровне может находиться определенное количество электронов. Максимальное число электронов на уровне определяется формулой N = 2 * n^2, где N - общее число электронов на энергетическом уровне, n - номер уровня.
Например, на первом уровне может находиться максимум 2 электрона, на втором - 8 электронов, на третьем - 18 электронов и так далее.
Каждый энергетический уровень делится на подуровни, которые заполняются по порядку. Например, первый уровень (K) содержит только один подуровень s, второй уровень (L) - s и p, третий уровень (M) - s, p и d, а четвертый уровень (N) - s, p, d и f.
См. также
Заполнение электронных оболочек
Заполнение электронных оболочек происходит по определенному алгоритму. Электроны заполняются сначала на нижних энергетических уровнях, а затем переходят на более высокие уровни. На каждом уровне сначала заполняются все доступные подуровни до максимального числа электронов.
Например, углерод (C) является элементом второго периода. У него на первом уровне (K) находятся 2 электрона, на втором уровне (L) - 4 электрона. Электронная формула углерода будет записываться как 1s^2 2s^2 2p^2.
Также важно отметить, что валентная оболочка, являющаяся самой внешней, играет ключевую роль в химических реакциях. Атомы с полностью заполненной валентной оболочкой считаются наименее активными (инертными газами), в то время как атомы с неполностью заполненной валентной оболочкой могут проявлять высокую химическую активность.

Примеры
Давайте рассмотрим некоторые примеры заполнения электронных оболочек:
- Атом углерода (C): 1s^2 2s^2 2p^2
- Атом натрия (Na): 1s^2 2s^2 2p^6 3s^1
- Атом хлора (Cl): 1s^2 2s^2 2p^6 3s^2 3p^5
Эти примеры демонстрируют, как электроны заполняются на различных энергетических уровнях и подуровнях в зависимости от порядкового номера химического элемента.
Заключение
Количество электронов в атоме определяется порядковым номером химического элемента. Электроны располагаются на энергетических уровнях, каждый из которых имеет определенное максимальное количество электронов. Заполнение электронных оболочек происходит согласно определенному алгоритму, где сначала заполняются нижние уровни и подуровни. Валентная оболочка играет важную роль в химических реакциях, определяя химическую активность атома.
См. также
Полезные ссылки
- Электронная оболочка атома (видео)
- Строение атома (Часть 1) (видео)
- Строение атома (Часть 2) (видео)
- Строение атома. Ядерные силы (видео)
Что нам скажет Википедия?
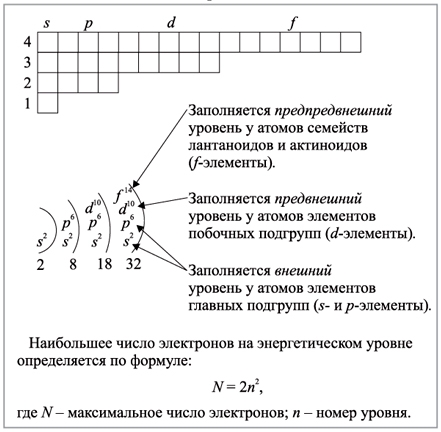
Количество электронов в каждой оболочке определяется по формуле:
2n^2, где n — номер оболочки.
Например, в первой оболочке (K) может быть максимум 2 электрона (2*1^2 = 2), во второй оболочке (L) — 8 электронов (2*2^2 = 8), в третьей оболочке (M) — 18 электронов (2*3^2 = 18), и так далее.
Оболочки атомов состоят из подуровней, которые заполняются электронами. Например, первая оболочка (K) состоит из одного подуровня «1s», вторая оболочка (L) состоит из двух подуровней, 2s и 2p, третья оболочка (M) — из «3s», «3p» и «3d», а четвертая оболочка (N) - из «4s», «4p», «4d», «4f». Каждый подуровень может содержать определенное количество электронов, которое определяется по формуле 2(2l + 1), где l — орбитальное квантовое число.
Валентная оболочка атома, являющаяся самой внешней, играет ключевую роль в химических реакциях. Атомы с полностью заполненной валентной оболочкой считаются наименее активными (инертными газами), в то время как атомы с неполностью заполненной валентной оболочкой могут проявлять высокую химическую активность.