Узнайте, как определить, какой элемент является менее электроотрицательным. Электроотрицательность атомов и ее влияние на химические связи и свойства веществ. Научитесь предсказывать химическое поведение элементов.
Cодержание
Электроотрицательность (χ) - это фундаментальное химическое свойство атома, которое качественно характеризует его способность притягивать к себе электроны других атомов. Чем выше значение электроотрицательности, тем сильнее атом притягивает электроны.
Введение
Современное понятие об электроотрицательности атомов было введено американским химиком Л. Полингом. Он использовал понятие электроотрицательности для объяснения разницы в энергии гетероатомной связи относительно гомоатомной связи.
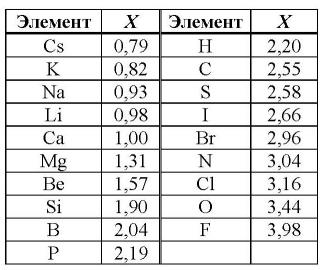
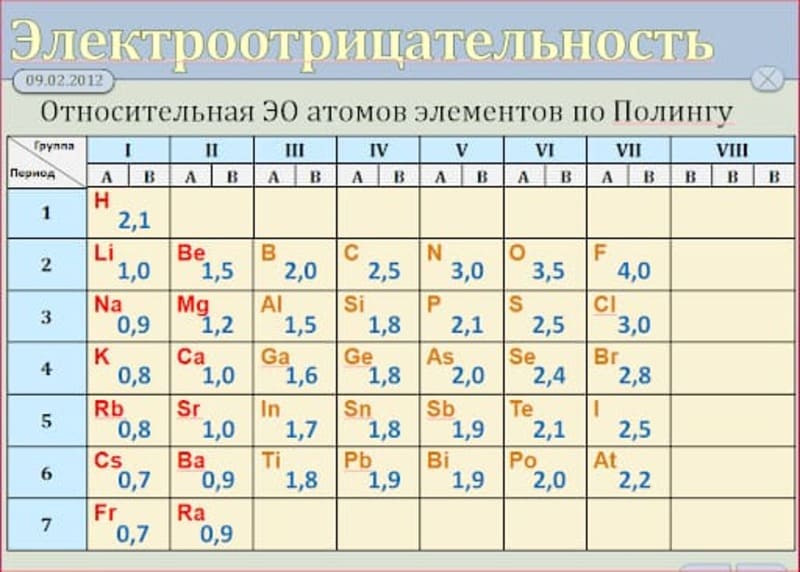
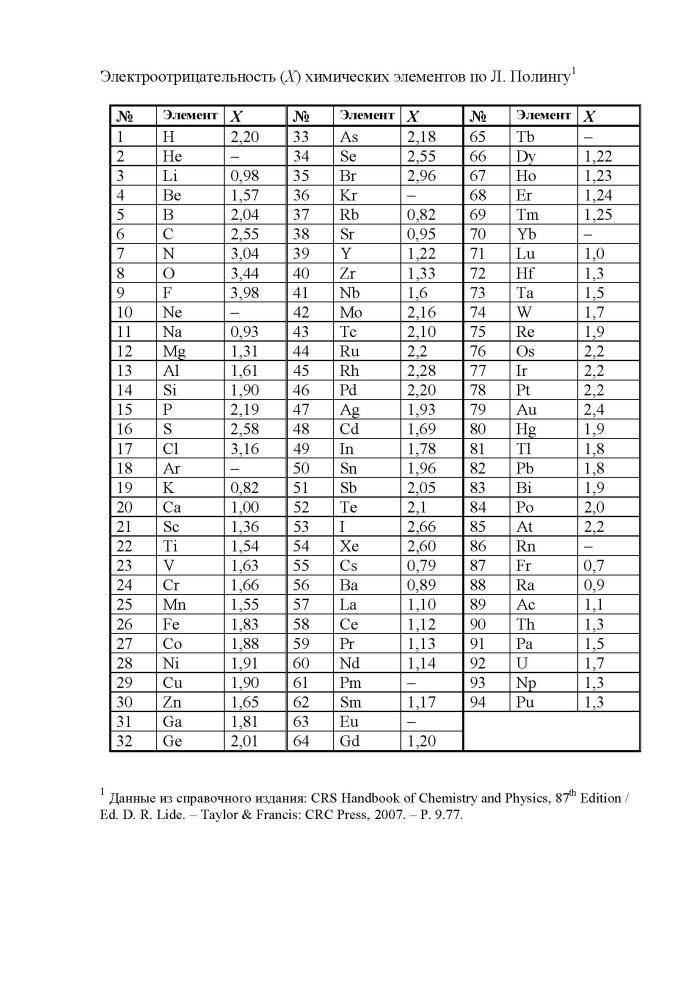
Первая и наиболее распространенная шкала электроотрицательностей, построенная Полингом, охватывает значения от 0,7 для атомов франция до 4,0 для атомов фтора. Фтор является самым электроотрицательным элементом, за ним следуют кислород, азот и хлор. Металлы, такие как натрий и калий, имеют наименьшие значения электроотрицательности, а галогены имеют наибольшие значения.

Определение электроотрицательности
Электроотрицательность определяется различными факторами, включая количество электронов в атоме, их удаленность от ядра и размер атома. Чем меньше размер атома и чем больше его зарядовое число, тем выше его электроотрицательность.
Знание значения электроотрицательности элементов позволяет предсказывать тип химической связи и химические свойства веществ. Более электроотрицательные элементы имеют большую склонность к притягиванию электронов и образованию ионов, тогда как менее электроотрицательные элементы имеют склонность к отдаче электронов и образованию положительно заряженных ионов.
См. также
Электроотрицательность и свойства элементов
Электроотрицательность элементов влияет на образование и характер химических соединений. Более электроотрицательные элементы образуют полярные химические связи и могут образовывать полярные молекулы, в которых центральный атом обладает частичным зарядом. Это влияет на физические свойства вещества, такие как температура плавления и кипения, растворимость и электропроводность.
Металлы обычно имеют более низкую электроотрицательность и проявляют металлические свойства, такие как хорошая электропроводность и теплопроводность. Неметаллы, с высокой электроотрицательностью, проявляют неметаллические свойства, такие как хрупкость и плохая электропроводность.
Значение электроотрицательности для изучения химических связей
Знание электроотрицательности элементов является важным для понимания молекулярной структуры и связей между атомами. Оно помогает предсказывать химические свойства веществ и использовать их в различных областях науки и промышленности, включая химию, биологию и материаловедение.
Таблица электроотрицательности химических элементов позволяет определить активность простых веществ и предсказать их химическое поведение. Наиболее электроотрицательным элементом является флуор (4,0), а наименее электроотрицательным - франций (0,7).
Заключение
Электроотрицательность является важным химическим свойством атомов и определяет их способность притягивать электроны. Различия в электроотрицательности элементов влияют на химические связи и свойства веществ. Более электроотрицательные элементы обладают большей силой притяжения электронов, тогда как менее электроотрицательные элементы имеют склонность отдавать электроны. Знание электроотрицательности элементов позволяет предсказывать химическое поведение веществ и применять их в различных областях науки и промышленности.
См. также
Что нам скажет Википедия?
Современное понятие об электроотрицательности атомов было введено американским химиком Л. Полингом. Он использовал понятие электроотрицательности для объяснения того факта, что энергия гетероатомной связи A—B (A, B — символы любых химических элементов) в общем случае больше среднего геометрического значения гомоатомных связей A—A и B—B.
Первая и широко известная (самая распространённая) шкала относительных атомных электроотрицательностей Полинга охватывает значения от 0,7 для атомов франция до 4,0 для атомов фтора. Фтор — наиболее электроотрицательный элемент, за ним следует кислород (3,5) и далее азот и хлор (щелочные и щёлочноземельные металлы имеют наименьшие значения электроотрицательности, лежащие в интервале 0,7—1,2, а галогены — наибольшие значения, находящиеся в интервале 4,0—2,5. Электроотрицательность типичных неметаллов находится в середине общего интервала значений и, как правило, близка к 2 или немного больше 2. Электроотрицательность водорода принята равной 2,2.
Строго говоря, элементу нельзя приписать постоянную электроотрицательность. Электроотрицательность атома зависит от многих факторов, в частности, от валентного состояния атома, формальной степени окисления, типа соединения, координационного числа, природы лигандов, составляющих окружение атома в молекулярной системе, и от некоторых других. В последнее время все чаще для характеристики электроотрицательности используют так называемую орбитальную электроотрицательность, зависящую от типа атомной орбитали, участвующей в образовании связи, и от её электронной заселённости, то есть от того, занята атомная орбиталь неподелённой электронной парой, однократно заселена неспаренным электроном или является вакантной.
Значения относительной электроотрицательности могут варьироваться в зависимости от используемой шкалы электроотрицательности. Первая и самая распространенная шкала электроотрицательностей, введенная Л. Полингом, охватывает значения от 0,7 для атомов франция до 4,0 для атомов фтора. В практической шкале электроотрицательностей атомов, основанной на концепции Луо-Бенсона, электроотрицательность атома пропорциональна энергии притяжения валентного электрона, находящегося на определенном расстоянии от атомного ядра. В этой шкале водород играет особую роль, и его электроотрицательность 2,7 определяет границу между металлами и неметаллами.