Узнайте, как ведут себя электроны в атоме согласно представлениям Бора и его модели атома. Излучение и поглощение энергии происходят при переходе электрона между стационарными орбитами. Узнайте, как эта модель нашла применение в объяснении спектральных линий атомов и была подтверждена опытом Франка-Герца.
Введение
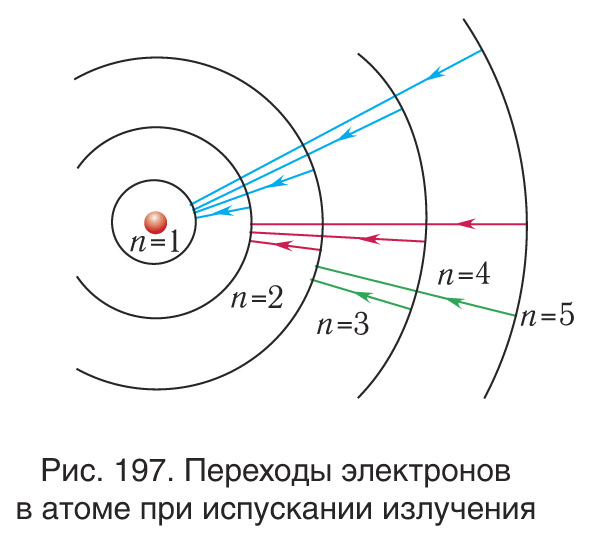
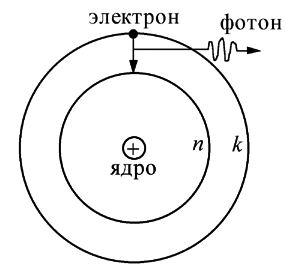
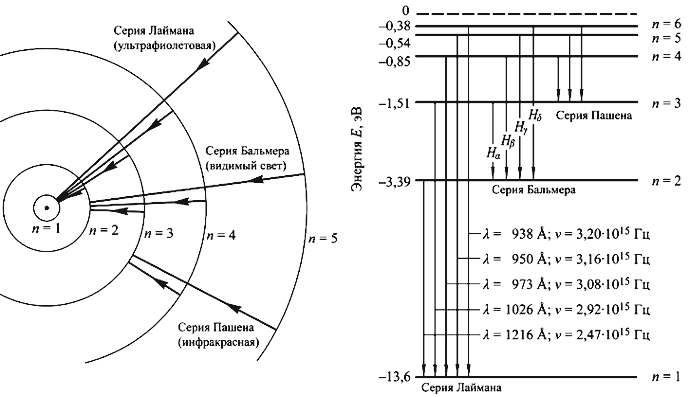
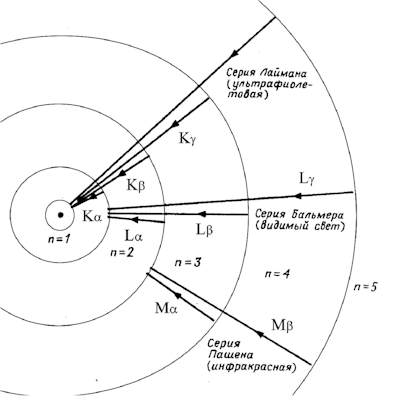
Боровская модель атома, предложенная Нильсом Бором в 1913 году, основана на планетарной модели атома, предложенной Эрнестом Резерфордом. В модели Резерфорда электрон, движущийся вокруг ядра, должен был бы непрерывно излучать энергию и упасть на ядро. Чтобы преодолеть эту проблему, Бор предположил, что электроны могут двигаться только по определенным стационарным орбитам, на которых они не излучают энергию. Излучение или поглощение энергии происходит только при переходе электрона с одной орбиты на другую. Стационарными считаются только орбиты, на которых момент количества движения электрона равен целому числу постоянных Планка.
Описание модели Бора
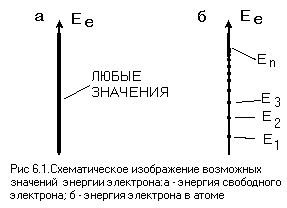
Боровская модель атома основывается на двух основных постулатах. Первый постулат утверждает, что электроны могут двигаться только по стационарным орбитам, на которых они не излучают энергию. Это значит, что электроны могут существовать только на определенных энергетических уровнях. Второй постулат связывает радиусы орбит и энергию электрона. Согласно этому постулату, энергия электрона на стационарной орбите определяется его радиусом и ядром атома.
Радиус стационарной орбиты электрона в атоме можно выразить через постоянную Планка, массу электрона, заряд ядра и электрическую постоянную. Формула для радиуса орбиты выглядит следующим образом:
| Радиус орбиты | Формула |
|---|---|
| Rn | Rn = n2 * h2 / (4π2 * me * e2 * Z) |
Здесь Rn - радиус орбиты, n - главное квантовое число, h - постоянная Планка, me - масса электрона, e - заряд электрона, Z - количество протонов в ядре атома.
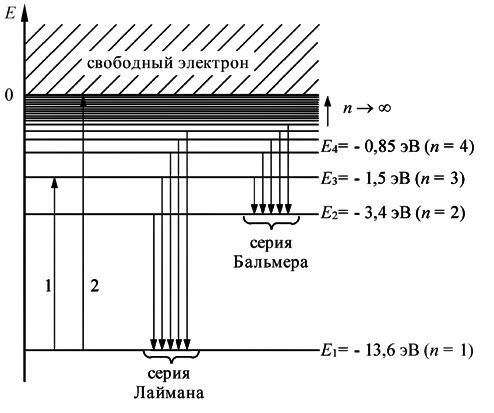
Энергия электрона на стационарной орбите также связана с его радиусом и ядром атома. Формула для энергии выглядит следующим образом:
| Энергия орбиты | Формула |
|---|---|
| En | En = -13.6 eV / n2 |
Здесь En - энергия орбиты, n - главное квантовое число. Отрицательный знак означает, что энергия электрона на стационарной орбите отрицательна. Это означает, что электрон привязан к ядру атома и нужно затратить энергию, чтобы удалить его с орбиты.

Применение и подтверждение модели Бора
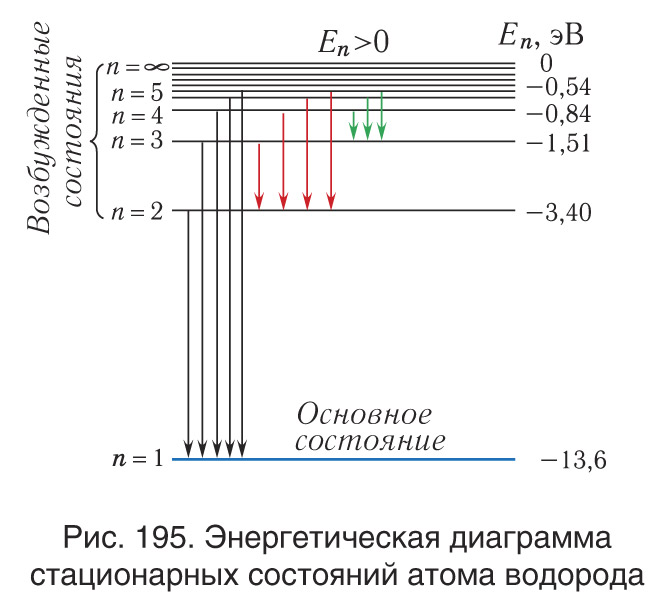
Боровская модель атома нашла применение в объяснении спектральных линий атомов. Спектральные линии возникают при переходе электронов с одной орбиты на другую, сопровождаясь излучением или поглощением энергии. Модель Бора позволяет предсказать частоты и энергии излучаемого или поглощаемого света при таких переходах.
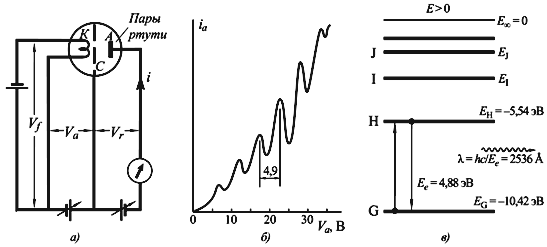
Модель Бора также нашла подтверждение в опыте Франка-Герца, который показал, что атомы могут поглощать или испускать энергию в количествах, равных разности энергий стационарных состояний. Опыт Франка-Герца подтвердил существование дискретных энергетических уровней в атомах, что соответствует представлениям Бора о стационарных орбитах электронов.
См. также
Заключение
Модель Бора описывает поведение электронов в атоме согласно планетарной модели атома. Согласно этой модели, электроны могут двигаться только по стационарным орбитам, на которых они не излучают энергию. Излучение или поглощение энергии происходит только при переходе электрона с одной орбиты на другую. Модель Бора нашла применение в объяснении спектральных линий атомов и была подтверждена опытом Франка-Герца. Она играет важную роль в современной физике и является одной из основных моделей атома.
Что нам скажет Википедия?
Боровская модель атома, предложенная Нильсом Бором в 1913 году, основана на планетарной модели атома, предложенной Эрнестом Резерфордом. В модели Резерфорда электрон, движущийся вокруг ядра, должен был бы непрерывно излучать энергию и упасть на ядро. Чтобы преодолеть эту проблему, Бор предположил, что электроны могут двигаться только по определенным стационарным орбитам, на которых они не излучают энергию. Излучение или поглощение энергии происходит только при переходе электрона с одной орбиты на другую. Стационарными считаются только орбиты, на которых момент количества движения электрона равен целому числу постоянных Планка.
Используя законы классической механики, Бор получил значения для радиуса стационарной орбиты и энергии электрона на этой орбите. Радиус первой орбиты в атоме водорода называется боровским радиусом и широко используется в современной физике. Энергия первой орбиты представляет собой энергию ионизации атома водорода.
Теория Бора основана на двух постулатах: первый постулат утверждает, что электроны могут двигаться только по стационарным орбитам, а второй постулат связывает радиусы орбит и энергию электрона. Зоммерфельд, используя релятивистское уравнение Шрёдингера, получил выражение для энергии водородных термов. Теория Бора нашла подтверждение в опыте Франка-Герца, который показал, что атомы могут поглощать или испускать энергию в количествах, равных разности энергий стационарных состояний.