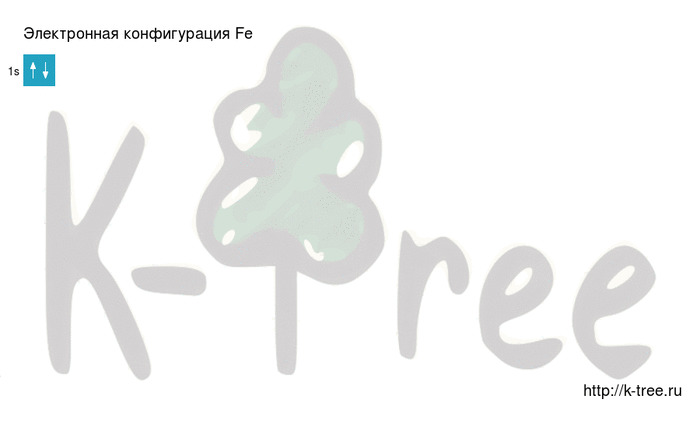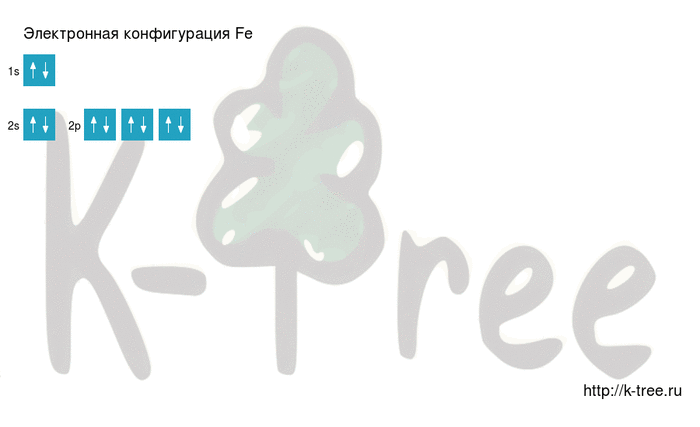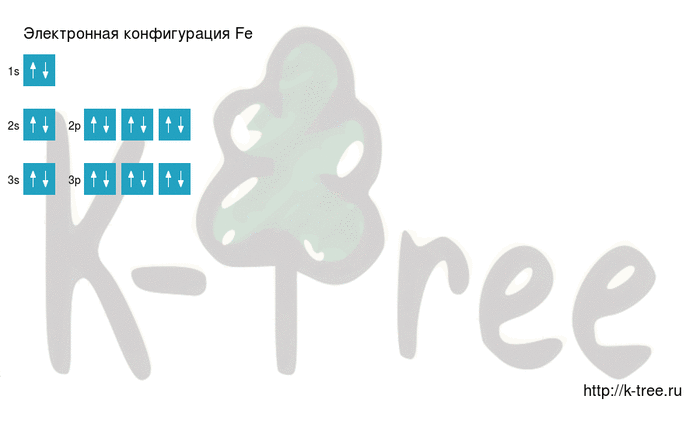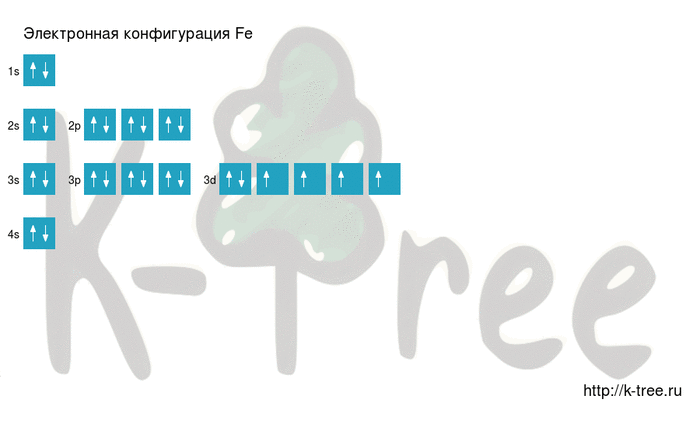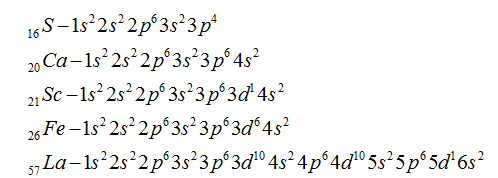Узнайте, какое максимальное главное квантовое число определяет состояние внешнего электрона атома железа. Подробное объяснение квантовых чисел и их связи с орбиталями и энергетическими уровнями.
Cодержание
Для понимания максимального главного квантового числа для атома железа, необходимо рассмотреть некоторые основные понятия из области квантовой механики и атомной структуры.
Энергия ионизации
Энергия ионизации - это энергия, необходимая для отрыва электрона от атома. Чем ближе электрон находится к центру атома, тем больше энергии требуется для его отрыва. Обычно энергия ионизации относится к отрыву первого электрона, но также существуют энергии ионизации для каждого последующего электрона.
Магнитное квантовое число
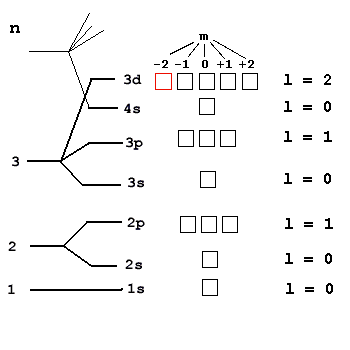
Магнитное квантовое число (m) является параметром, вводимым в уравнении Шрёдингера для электрона в атоме. Оно описывает ориентацию в пространстве орбитального момента импульса электрона или пространственное расположение атомной орбитали. Магнитное квантовое число принимает целые значения от -l до +l, где l - орбитальное квантовое число. Оно имеет столько значений, сколько орбиталей существует на каждом подуровне.
В магнитном поле спектры атомов становятся сложными, и количество линий в спектрах испускания возрастает. Каждая p-линия распадается на 3 новых линии, каждая d-линия - на 5, каждая f-линия - на 7 линий, а s-линии не изменяются. Магнитное квантовое число определяет "адрес" орбитали в атоме и является причиной расщепления спектральных линий атома в магнитном поле.
См. также
Квантовые числа атомных электронов
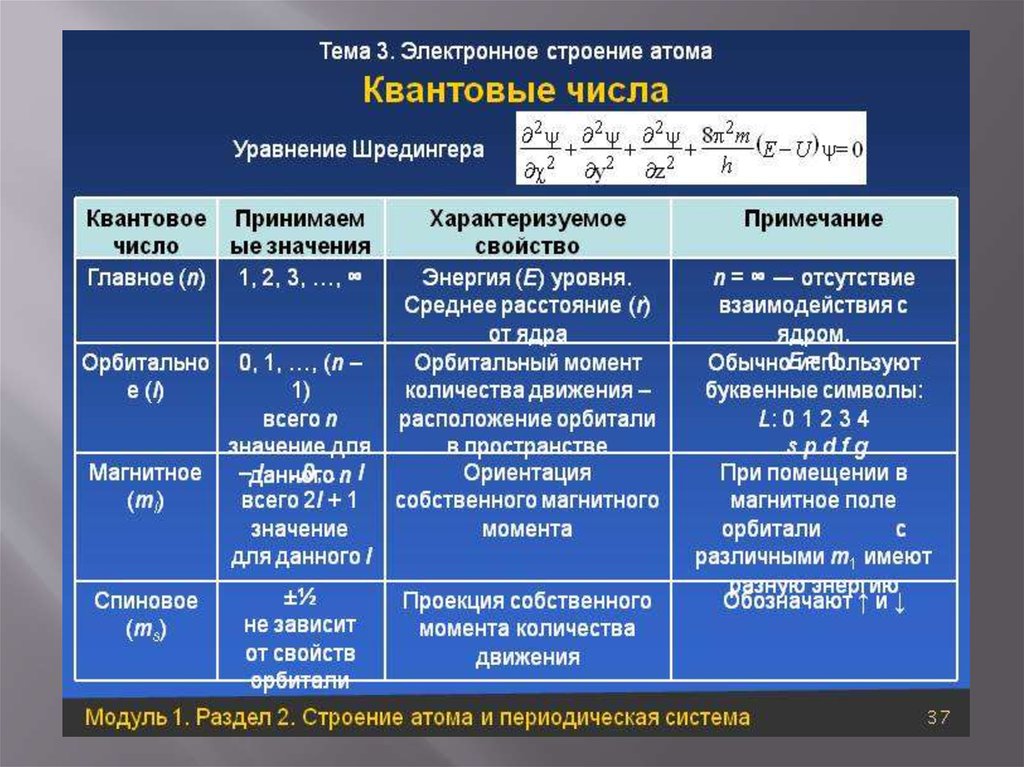
Для полного описания состояния внешнего электрона в атоме используются четыре квантовых числа: главное квантовое число (N), орбитальное квантовое число (L), магнитное квантовое число (Ml) и спин (S).
Главное квантовое число (N) характеризует энергетический уровень электрона и определяет размер энергетического уровня. Чем больше значение N, тем больший радиус орбиты, на которой находится электрон.
Орбитальное квантовое число (L) обозначает форму области, в которой может находиться электрон. Оно принимает значения s (L=0), p (L=1), d (L=2), f (L=3) и также называется энергетической оболочкой или энергетическим подуровнем. На каждой орбитали находится "2·L + 1" орбиталей.
Магнитное квантовое число (Ml) обозначает орбиталь, на которой находится электрон. Оно может принимать значения ±L. Проекция магнитного момента на ось z связана с проекцией орбитального момента импульса на ось z.
Спин (S) электрона может быть +½ или -½, обозначая прямое или обратное вращение электрона.

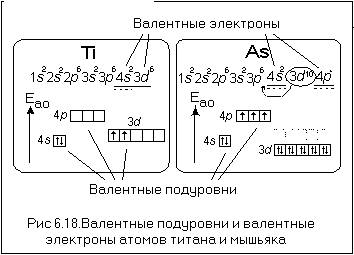
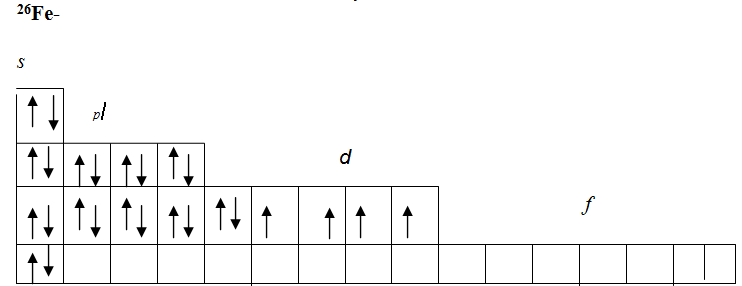
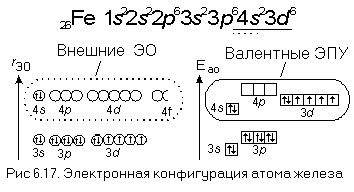
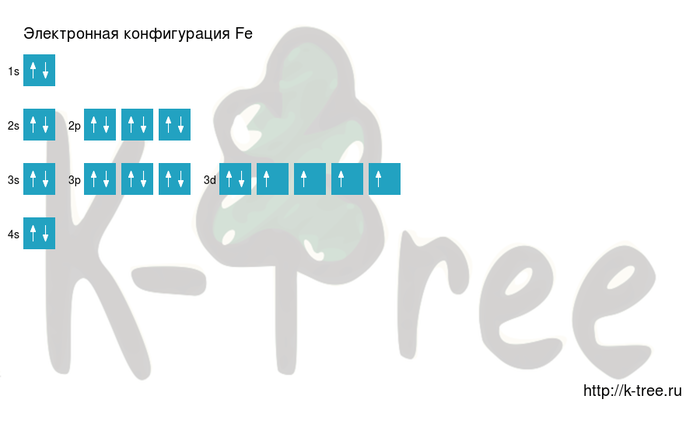
Максимальное главное квантовое число для атома железа
Для атома железа (Fe) максимальное главное квантовое число зависит от энергетического уровня, на котором находится внешний электрон. Внешний электрон железа находится на энергетическом уровне 3. Поэтому максимальное главное квантовое число для атома железа равно 3.
Орбитальные квантовые числа для атома железа могут быть следующими:
- Для энергетического уровня 3s: N=3, L=0, Ml=0
- Для энергетического уровня 3p: N=3, L=1, Ml=-1, 0, 1
- Для энергетического уровня 3d: N=3, L=2, Ml=-2, -1, 0, 1, 2
- И так далее для более высоких энергетических уровней.
Таким образом, максимальное главное квантовое число для атома железа равно 3, а орбитальные и магнитные квантовые числа зависят от энергетического уровня и определяют форму и местоположение орбиталей.
Что нам скажет Википедия?
Магни́тное ква́нтовое число́ (m) — квантовое число, параметр, который вводится при решении уравнения Шрёдингера для электрона в водородоподобном атоме (и вообще для любого движения заряженной частицы). Магнитное квантовое число характеризует ориентацию в пространстве орбитального момента импульса электрона или пространственное расположение атомной орбитали. Оно принимает целые значения от -l до +l, где l — орбитальное квантовое число, то есть имеет ровно столько значений, сколько орбиталей существует на каждом подуровне.
Магнитное квантовое число в переходах между уровнями может изменяться лишь на определённое значение, устанавливаемое правилами отбора для данного типа перехода.